Фармакодинамiка.
Механiзм дiї. Препарат Солiква це комбiнацiя двох дiючих речовин iз взасмодоповнюючими механiзмами дiї для покращення контролю глiкeмiї, а саме iнсулiну глapгiнy (аналог базального iнсулiну, головною метою якоrо є контроль рiвнiв глюкози в плазмi кровi натще) та лiксисенатиду (агонiст рецепторiв до ГПП-1, головною метою якого с контроль постпрандiальних рiвнiв rлюкози).
Інсулiн глapгiн. Найважливiшою дiєю iнсулiну, в тому числi iнсулiну глapгiнy, є регуляцiя метаболiзму глюкози. Iнсулiн та його аналоги знижують рiвень глюкози в кровi за рахунок стимуляцiї її захоплення периферичними тканинами, зокрема скелетними м'язами та жировою тканиною, а також приrнiчення утворення rлюкози у печiнцi. lнсулiн пригнiчує лiполiз та протеолiз, а також стимулює синтез бiлкiв.
Лiксисенатид. Лiксисенатид с агонiстом рецепторiв до глюкаrоноподiбного пептиду- 1 (ГПП-1). Рецептори до ГПП-1 є мiшенню природного ГПП-1 - ендогенного гормону iнкретину, який потенцiює глюкозозалежну секрецiю iнсулiну β-клiтинами та приrнiчує секрецiю глюкагону α-клiтинами пiдшлунково'i залози.
Лiксисенатид стимулюс секрецiю інсуліну при підвищенні рівнів глюкози в крові, не впливаючи при цьому на секрецію інсуліну при нормоглікемії, що обмежує ризик виникенення гіпоглікемії. Паралельно пригнічується секреція глюкагону. У випадку виникнення гiпоглiкемiї рятуваьний механiзм у виглядi секрецiї глюкагону зберігається. Постпрандіальне введення ліксисенатиду також сповільнює спорожнення шлунку, знижуючи таким чином швидкість абсорбцiї та надходження в систему кровообiгу глюкози, що мiститься в їжi.
Фармакодинаміка..
Комбiнацiя iнсулiну гларгiну та лiксисенатиду не впливає на фармакодинамiку iнсулiну гларгiну. Вплив комбiнацiї iнсулiну гларгiну та лiксисенатиду на фармакодинамiку лiксисенатиду не вивчався в рамках дослiджень I фази.
Враховуючи вiдносно постiйний профiль "концентрація/час" інсуліну гларгіну впродовж 24 годин без виражених пiкiв при застосуваннi його окремо, профiль «швидкiсть утилiзацiї глюкози/час» був подiбним при застосуваннi комбiнацiї iнсулiну гларгiну та ліксисенатиду.
Період дії інсулінів, в тому числi препарату Солiква, може вiдрiзнятись у рiзних осiб i навiть бути рiзним в однiєї тiєї ж особи.
Iнсулiн гларгiн. За результатами клiнiчних дослiджень iз застосуванням iнсулiну гларгiну (100 од/мл) цукрознижуючий ефект на молярнiй основi (тобто при застосуваннi однакових доз) iнсулiну гларгiну при його внутрiшньовенному введеннi є приблизно таким самим, як людського iнсулiну.
Лiксисенатид. За результатами 28-денного плацебо-контрольованого дослiдження серед пацiентiв з цукровим дiабетом 2 типу застосування лiксисенатиду в дозi 5-20 мкг призводило до статистично значущого зниження постпрандiальних рiвнiв глюкози пiсля снiданку, обiду та вечерi.
Спорожнення шлунку. Пiсля вживання стандартної мiченої дослiджуваної їжi в рамках зазначеного вище дослiдження було пiдтверджено, що лiксисенатид сповiльнює спорожнення шлунку, знижуючи таким чином швидкiсть постпрандiальної абсорбцiї глюкози. Ефект сповiльнення спорожнення шлунку пiдтримувався до завершення дослщження.
Клiнiчна ефективнiсть та безпека. Безпека та ефективнiсть препарату Солiква стосовно контролю глiкемiї оцiнювались у трьох рандомiзованих клінічних дослiдженнях серед пацiєнтiв з цукровим дiабетом 2 типу:
- Додавання до метформiну (у пацiєнтiв, що не отримували iнсулiн). Перехiд вiд базального iнсулiну.
- Перехiд вiд агонiсту рецепторiв ГПП-1
У кожному з дослiджень з активним контролем лiкування лікарським засобом Солiква призводило до клінічно та статистично значущого покращення рівнів глікованого гемоглобiну (НЬА1с).
Досягнення нижчих рiвнiв НЬА1с та досягнення бiльш значного зниження рiвнiв НЬА1с не призводило до збiльшення частоти виникнення гiпоглiкемiї при комбiнованому лiкуваннi порiвняно з монотерапiею iнсулiном гларгiном (див. роздiл «Побiчнi реакцiї»).
В рамках клiнiчного дослiдження з додаванням препарату до метформiну лiкування розпочиналось з 10 подiлок дозування (10 одиниць iнсулiну гларгiну та 5 мкг лiксисенатиду). В рамках клiнiчного дослiдження з переходом вiд базального iнсулiну початкова доза становила 20 подiлок дозування (20 одиниць iнсулiну гларгiну та 10 мкг лiксисенатиду) або 30 подiлок дозування (30 одиниць iнсулiну гларгiну та 10 мкг лiксисенатиду) (див. роздiл «Спосiб застосування та дози»), в залежностi вiд попереднього дозування iнсулiну. В обох дослiдженнях титрування дозування здiйснювалось один раз на тиждень, враховуючи рiвнi глюкози в плазмi кровi натще, що визначались самостiйно.
Додавання до метформiну (у пацiентiв, що не отримували iнсулiн).
Клiнiчие дослiдження серед пацiснтiв з цукровим дiабетом 2 типу, в яких на фонi лiкування пероральним протидiабетичним препаратом не вiдзначалось належного контролю захворювання. Всього в рамках вiдкритого, 30-тижневого дослiдження з активним контролем було рандомiзовано 1170 пацiентiв з цукровим дiабетом 2 типу для оцiнки ефективностi та безпеки препарату Солiква порiвняно з окремими компонентами інсуліном гларгіном (10 од/мл) та ліксисенатидом (20мкг).
Пацієнти з цукровим діабетом 2 типу, які отримували лікування метформіном у вигляді монотерапії або метформіном в комбінації з іншим пероральний протидіабетичним препаратом, яким мiг бути препарат сульфонiлсечовини, глiнiд, iнгiбiтор натрiйзалежного котранспортера глюкози-2 (НЗКГ-2) або iнгiбiтор дипептидилпептидази-4 (ДПП-4), та у яких не вiдзначалось належного контролю захворювання на фонi даного лiкування (рiвнi НЬА1с коливались в межах вiд 7,5% до 10,0% у пацiєнтiв, якi ранiше отримували метформiн у виглядi монотерапiї, та в межах вiд 7,0% до 9,0% у пацiєнтiв, якi ранiше отримували лiкування метформiном в комбiнацiї з iншим пероральним протидiабетичним препаратом), були включенi у вступний пepioд впродовж 4 тижнів. Впродовж цiєї вступної фази здiйснювалась оптимiзацiя лiкування метформiном, а прийом iнших пероральних протидiабетичних препаратiв припинявся. В кiнцi вступного перiоду пацiєнти, в яких продовжувався вiдзначатись неналежний контроль захворювання (рiвнi HbAlc коливались в межах вiд 7% до l U%), були рандомiзованi в групи, якi отримували препарат Солiква, iнсулiн глapгiн або лiксисенатид. З 1479 пацiснтiв, якi були включенi у вступну фазу дослiдження, 1170 були рандомiзованi. Головними причинами, якi не дозволяли включити пацiєнтiв у рандомiзацiйну фазу дослiджения, були рiвнi глюкози в плазмi кровi натще > 13,9 ммоль/л та рiвнi НЬА1с < 7% або > 10% в кiнцi вступної фази дослiдження.
Характеристики популяцiї рандомiзованих пацiєнтiв з цукровим дiабетом 2 типу були наступними: Середнiй вiк становив 58,4 рокiв, при цьому вiк бiльшостi пацiснтiв (57,1%) становив вiд 50 до 64 рокiв, 50,6% пацiснтiв були чоловiками. Середнiй iндекс маси тiла (IМТ) на вихiдному рiвнi становив 31,7 кr/м2, при цьому у 63,4% пацiєнтiв IMT становив більше 30 кг/м2. Середия тривалiсть цукровоrо дiабету становила приблизно 9 рокiв. Метформiн був обов'язковою фоновою терапiсю, а 58% пацiєнтiв отримували на скринiнrу також iнший пероральний протидiабетичний препарат, яким у 54% пацiентiв був препарат сульфонiлсечовини.
На тижнi 30 лiкування препаратом Солiква призводило до статистично значущоrо покращення рiвнiв НЬА1с (р-значення < 0,0001) порiвняно з окремими компонентами. За результатами попередньо визначеноrо аналiзу цiєї первинної кiнцевої точки вiдзначенi вiдмiнностi узrоджувались стосовно вихiдних рiвнiв HbA1c (< 8% або > 8%) або перорального протидiабетичноrо лiкування на вихiдному рiвнi (метформiн у виглядi монотерапi'i або метформiн у комбiнацiї з iншим пероральним протидiабетичним препаратом).
lнформацiя щодо iнших кiнцевих точок дослiдження наведена нижче в таблицi та на зображеннi.
Результати клiнiчного дослiдження з додаванням препарату до метформiну на Тижнi 30 (попvляцiя пацiєнтiв, якi отримали лiкування)
| |
Препарат Соліква |
Інсулін гларгін |
Лiксисенатид |
| Кiлькiсть пацiєнтiв, якi отримали лiкування |
468 |
466 |
233 |
| Рiвень НЬАlс (%) |
|
|
|
| Вихiдний рiвень (середнє значення, пiсля вступної фази) |
8,1 |
8,1 |
8,1 |
| Завершення дослідження (середнє значення) |
6,5 |
6,8 |
7,3 |
| Змiна порiвняно з вихiдним рівнем, визначена методом найменших квадратiв (середнє значення) |
-1,6 |
-1,3
|
-0,9 |
Відмінність порівняно з інсуліном гларгіном [95% довiрчий iнтервал]
(о-значения) |
|
-0,3
[-0,4; -0,2] (<0,0001)
|
|
Відмінність порівняно з ліксисенатидом
[95% довiрчий iнтервал] (р-значення) |
|
|
-0,8
[-0,9; -0,7] (<0,0001)
|
| Кiлькiсть пацiснтiв (%), у яких були досяrнуті рівні HbA1c < 7% на Тижні 30* |
345 (74%) |
277 (59%) |
77 (33%) |
| Рiвень глюкози в плазмi кровi натще (ммоль/л) |
|
|
|
| Вихідний рівень (середнє значення) |
9,88 |
9,75 |
9,79 |
| Завершения дослiдження (середнє значения) |
6,32 |
6,53 |
8,27 |
|
Змiна порiвняно з вихiдним рiвнем, визначена методом найменших квадратів (середнє значення)
[95% довiрчий iнтервал]
(р-значення)
|
|
-0,19
-0,420; 0,038] (0,1017)
|
|
| Зміна порівняно з ліксисенатидом, визначена методом найменших квадратів (середнє значення)
[95% довiрчий iнтервал]
(р-значення)
|
|
|
-1,96
[-2,246; -1,682] (<0,0001) |
| Постпрандiальний рiвень глюкози через 2 години пiсля прийому їжi (ммоль/л)** |
|
|
|
| Вихiдний рiвень (середнє значення) |
15,19 |
14,61 |
14,72 |
| Завершення дослiдження (середие значення) |
9,15 |
11,35 |
9,99 |
| Змiна порiвняно з вихiдним рiвнем, визначена методом найменших квадратів |
-5,68 |
-3,31 |
-4,58 |
| Зміна порівняно з інсуліном гларгіном, визначена методом найменших квадратів (середнє значення)
[95% довiрчий iнтервал]
(р-значення)
|
|
-2,38
[-2,79; -1,96]
|
|
| Зміна порівняно з ліксисенатидом, визначена методом найменших квадратів (середнє значення)
[95% довiрчий iнтервал]
(р-значення)
|
|
|
-1,10
[-1,63; -0,57]
|
| Середня маса тіла (кг) |
|
|
|
| Вихiдний рiвень (середнє значення) |
89,4 |
89,8 |
90,8 |
|
Змiна порiвняно з вихiдним рiвнем, визначена методом найменших квадратів
|
-0,3 |
1,1 |
-2,3 |
| Порівняння з інсуліном гларгіном
[95% довiрчий iнтервал]
(р-значення)
|
|
-1,4 [-1,9; -0,9] (<0,0001) |
|
| Порівняня з ліксисенатидом
[95% довiрчий iнтервал]
(р-значення)
|
|
|
2,01 [1,4; 2,5] |
| Кiлькiсть пацiєнтів (%), у яких були досягнутi рiвнi HbA1c <7,0% без приросту маси тiла на Тижнi 30 |
202
(43,2%)
|
117
(25,1%)
|
65
(27,9%)
|
|
Пропорцiйна вiдмiннiсть порiвняно з iнсулiном гларгiном
[95% довiрчий iнтервал]
(р-значення)
|
|
18,1 [12,2; 24,01] (< 0,0001) |
|
|
Пропорційна відмінність порівняно з лiксисенатидом
[95% довiрчий iнтервал]*
|
|
|
15,2
[8,1; 22,4]
|
| Добова доза інсуліну гларгіну |
|
|
|
| Доза iнсулiну на Тижнi 30, визначена методом найменших квадратів(середнє значення) |
39,8 |
40,5 |
Не застосовано |
*Не включено в попередньо визначенiй процедурі дослiдження поступового зниження рівнів
** Постпрандiальнии рiвень глюкози через 2 години пiсля прийому їжі мiнус рівень глюкози перед прийомом їжi
Зображення - Середнi рiвнi НЬАlс (%) на вiзитах протягом 30 тижнiв лiкування
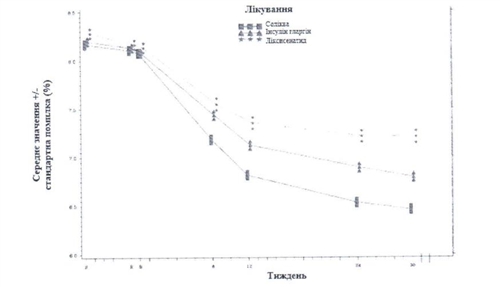
У пацiєнтiв групи препарату Солiква вiдзначено статистично значуще бiльше зниження середнього профiлю рiвнiв глюкози в плазмi кровi, що визначались самостiйно на 7 часових точках, вiд вихiдного рiвня до Тижня 30 (-3,35 ммоль/л) порiвняно з пацiєнтами групи iнсулiну гларгiну (-2,66 ммоль/л; вiдмiннiсть -0,69 ммоль/л) та з пацiєнтами rрупи лiксисенатиду (-1,95 ммоль/л; вiдмiннiсть -1,40 ммоль/л) (р < 0,0001 для обох порiвнянь). На всiх часових точках на Тижнi 30 середнi рiвнi rлюкози в плазмi кровi були нижчими в групi препарату Солiква порiвняно як з групою iнсулiну гларгiну, так i з групою лiксисенатиду, за винятком тiльки рiвнiв глюкози перед снiданком, якi були подiбними в групi лiкарського засобу Солiква та в групi iнсулiну глapriнy.
Перехiд вiд базального інсуліну
Клінічне дослідження серед пацiєнтiв з цукровим дiабетом 2 типу, в яких на фонi лiкувания базальним iнсулiном не вiдзначалось належного контролю захворювання
Загалом 736 пацiєнтiв з цукровим дiабетом 2 типу взяли участь в рандомiзованому, 30-тижневому, з активним контролем, вiдкритому, з 2 групами лiкування, в паралельних групах, багатоцентровому дослiдженнi з оцiнкою ефективностi та безпеки препарату Соліква порівняно з інсуліном гларгіном (100 од/мл).
Скриновані пацієнти з цукровим діабетом 2 типу отримували лікування базальним інсуліном впрдовж щонайменше 6 місяців в стабільній добовій дозі від 15 до 40 МО у виглядi монотерапiї або в комбiнацiї з одним або двома пероральними протидіабетичними препаратами (метформін, препарат сульфанілсечовини, глінід, інгібітор НЗКТГ-2 або інгібітор ДПП-4), при цьому рівні HbA1c у них становили вщ 7,5% до 10% (середнiй рівень HbA1c на скринінгу становив 8,5%), а рiвнi глюкози в плазмi кровi натще становили < 10,0 ммоль/л або < 11,1 ммоль/л в залежності від попереднього протидіабетичного лікування.
Пiсля скринiнгу пацієнти, якi були визначенi придатними для участi в дослiдженнi (n = 1018), включались в 6-тижневу вступну фазу, влродовж якої пацiєнти продовжували отримувати інсулін гларгін або були переведенi на лiкування iнсулiном гларгiном у випадку, якщо вони отримували iнший базальний iнсулiн; при цьому здiйснювалось титрування/стабiлiзацiя дози iнсулiну на фонi продовження терапiї метформiном (якщо вiн приймався до цього). Лiкування будь-якими iншими пероральними протидiабетичними препаратами було припинене.
Пiсля завершения вступного періоду пацієнти, у яких рівні HbA1c становили від 7 до 10%, рiвнi глюкози в плазмi кровi натще становили менше 7,77 ммоль/л, а добова доза iнсулiну гларгiну становила вiд 20 до 50 одиниць, були рандомiзованi в групу препарату Солiква (n = 367) або в групу iнсулiну гларгiну (n = 369).
Характеристики популяцiї даних пацiєнтiв з цукровим дiабетом 2 типу були наступними: Середнiй вiк становив 60,0 рокiв, при цьому вiк бiльшостi пацiєнтiв (56,3%) становив вiд 50 до 64 рокiв, 53,3% пацiєнтiв були жiночої статi. Середнiй iндекс маси тiла (IMT) на вихiдному рiвнi становив 31,1 кг/м2, при цьому у 57,3% пацiєнтiв IMT становив більше 30 кr/м2. Середня тривалiсть цукрового дiабету становила лриблизно 12 рокiв, а середня тривалiсть попереднього лiкування базальним iнсулiном - приблизно 3 роки. На скринiнгу 64,4% пацiєнтiв в якостi базального iнсулiну отримували iнсулiн гларгiн, а 95,0% отримували принаймнi один пероральний протидiабетичний препарат.
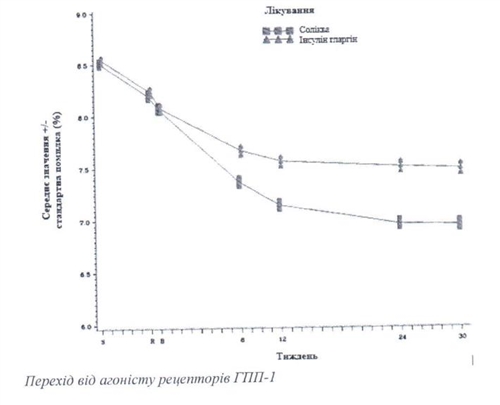
На Тижнi 30 лiкування препаратом Солiква призводило до статистично значущого покращення рiвнiв НЬА 1 с (р-значення < 0,0001) порiвняно з iнсулiном гларriном.
Iнформацiя щодо iнших кiнцевих точок дослiдження наведена нижче в таблицi та на зображеннi.
Результати клiнiчного дослiдження серед пацiснтiв з цукровим дiабетом 2 типу, в яких не вiдзначався належний контроль захворювання на фонi лiкування базальним iнсулiном, на Тижнi 30 (попvляцiя пацiснтiв, якi отримали лiкування)
| |
Препарат Соліква
|
Інсулін гларгін
|
|
Кількість пацієнтів, які отримали лікування
|
366 |
365 |
| Рівень HbA1c (%) |
|
|
|
Вихідний рівень (середнє значення, після вступної фази)
|
8,1 |
8,1 |
|
Завершення лікування (середнє значення)
|
6,9 |
7,5 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
-1,1 |
-0,6 |
|
Відмінність порівняно з інсуліном гларгіном [95% довірчий інтервал]
(р-значення)
|
-0,5
[-0.6; -0.4]
(<0,0001)
|
|
Кількість пацієнтів [п (%)], у яких були досягнуті рівні НЬАІс < 7% на Тижні 30
|
201 (54,9%) |
108 (29,6%) |
|
Рівень глюкози в плазмі крові натще (ммоль/л)
|
|
|
|
Вихідний рівень (середнє значення)
|
7,33 |
7,32 |
|
Завершення дослідження (середнє значення)
|
6,78 |
6,69 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
-0,35 |
-0,46 |
|
Відмінність порівняно з інсуліном гларгіном [95% довірчий інтервал]
|
0,11
(-0,21; 0,43)
|
|
Постпрандіальний рівень глюкози через 2 години після прийому їжі (ммоль/л)**
|
|
|
| Вихідний рівень (середнє значення) |
14,85 |
14,97 |
|
Завершення дослідження (середнє значення)
|
9,91 |
13,41 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадраіів (середнє значення)
|
-4,72 |
-1,39 |
|
Зміна порівняно з інсуліном гларгіном, визначена методом найменших квадратів (середнє значення) 95% довірчий інтервал
|
-3,33
[-3,89: -2.77]
|
| Середня маса тіла (кг) |
|
|
|
Вихідний рівень (середнє значення)
|
87,8 |
87,1 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
-0,7 |
0,7 |
|
Порівняння з інсуліном гларгіном [95% довірчий інтервал] (р-значення)
|
|
-1,4 [-1,8;-0,9] (< 0,0001)
|
|
Кількість пацієнтів (%), у яких були досягнуті рівні НЬАІс < 7,0% без приросту маси тіла на Тижні 30
|
125 (34,2%)
|
49 (13,4%)
|
|
Пропорційна відмінність порівняно з інсуліном гларгіном
[95% довірчий інтервал]
(р-значення)
|
20.8 [15,0; 26,7] (< 0,0001)
|
|
Добова доза інсуліну гларгіну
|
|
|
|
Вихідний рівень (середнє значення)
|
35,0 |
35,2 |
|
Кінцева точка (середнє значення)
|
46,7 |
46,7 |
|
Зміна дози інсуліну на Тижні ЗО, визначена методом найменших квадратів (середнє значення)
|
10,6 |
10,9 |
* Не включено в попередньо визначеній процедурі дослідження поступового зниження рівнів
** Постпрандіальний рівень глюкози через 2 години після прийому їжі мінус рівень глюкози перед прийомом їжі
Зображення - Середні рівні НЬАІс (%) на візитах протягом 30 тижнів лікування
.
.
Клiнiчне дослiдження серед пацiєнтiв з цукровим дiабетом 2 типу, в яких на фонi лiкування агонiстом рецепторiв ГПП-1 не вiдзначалось належного контролю захворювання
Ефективнiсть та безпека препарату Солiква в порiвняннi з незмiнним попереднiм лiкуванням агонiстом рецепторiв ГПП-1 були вивченi в 26-тижневому рандомiзованому вiдкритому дослiджсннi. У дослiдженнi приймало участь 514 пацiєнтiв iз цукровим дiабетом 2 типу, в яких не вiдзначалося належного контролю (рівень НЬАІс від 7% до 9% включно) захворювання, та які отримували лікування ліраглутидом або ексенатидом протягом не менше 4 місяців або дулаглутидом, албіглутидом або ексенатидом з пролонгованим вивільненням протягом не менше 6 місяців (усі препарати вводилися в максимально переносимій дозі), і метформіном у вигляді монотерапії або в поєднанні з піоглітазоном, інгібітором натрій-глюкозного котранспортеру-2 або з обома. Відібрані пацієнти були рандомізовані або для прийому препарату Соліква, або для продовження прийому попереднього агоніста рецепторів ГПП-1 на додаток до попереднього перорального протидіабетичного лікування.
На скринінгу 59,7% суб'єктів отримували агоніст рецепторів ГПП-1 один або двічі на день, а 40,3% отримували агоніст рецепторів ГПП-1 один раз на тиждень. Під час скринінгу 6,6% суб'єктів отримували піоглітазон, а 10,1% — інгібітор натрій-глюкозного котранспортеру 2-го типу в комбінації з метформіном. Характеристики популяції дослідження були наступні: середній вік становив 59,6 років. 52,5% суб'єктів були чоловіки. Середня тривалість діабету становила 11 років, середня тривалість попереднього лікування агоністами рецепторів ГПП-1 становила 1,9 року, середній ІМТ становив приблизно 32,9 кг/м2, середня рШКФ становила 87,3 мл/хв/1,73 м2 і 90,7% пацієнтів мали рШКФ >60 мл/хв.
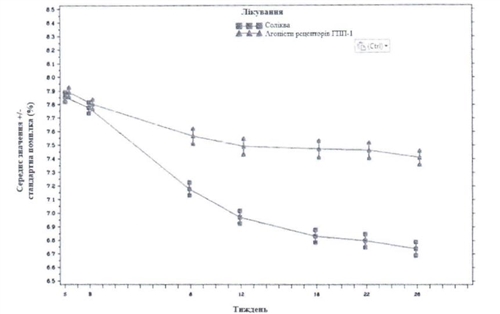
На Тижні 26 лікування препаратом Соліква призводило до статистично значущого покращення рівнів НЬАІс (р <0,0001). Попередньо визначений аналіз підтипу агоніста рецепторів ГПП-1 (один/два рази на день або щотижня), використаного під час скринінгу, показав, що зміна НЬАІс на тижні 26 було аналогічною для кожної підгрупи і узгоджується з первинним аналізом для всієї популяції. Середня добова доза препарату Соліква на Тижні 26 становила 43,5 поділок дозування.
Інформація щодо інших кінцевих точок дослідження наведена нижче в таблиці та на зображенні.
Результати клінічного дослідження серед пацієнтів із цукровим діабетом 2 типу, в яких не відзначався належний контроль захворювання на фоні лікування агоністами рецепторів ГПП -1 на Тижні 26 (популяція пацієнтів, які отримали лікування)
| |
Соліква |
Агоніст рецепторів ГПП-1 |
|
Кількість пацієнтів, які отримали лікування
|
252 |
253 |
|
Рівень НЬАІс (%)
|
|
|
|
Вихідний рівень (середнє значення, після вступної фази)
|
7,8 |
7,8 |
|
Завершення лікування (середнє значення)
|
6,7 |
7,8 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
-1,0 |
-0,4 |
|
Відмінність порівняно з агоністом рецепторів до ГПП-1 [95% ДІ] (р-значення)
|
-0.6
(<
[-0.8: -0,5]
0.0001)
|
|
Кількість пацієнтів [п (%)], у яких були досягнуті рівні НЬАІс < 7 % на Тижні 26
|
156(61,9%)
|
65 (25,7%) |
|
Пропорційна відмінність порівняно з агоністом рецепторів ГПП-1 (95% ДІ)
|
36.1 % (28,1 %: 44.0%)
|
| р-значення |
<0,0001
|
|
Рівень глюкози в плазмі крові натще (ммоль/л)
|
|
|
|
Вихідний рівень (середнє значення)
|
9,06 |
9,45 |
|
Завершення дослідження (середнє значення)
|
6,86 |
8,66 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
-2,28 |
-0,60 |
|
Відмінність порівняно з агоністом рецепторів до ГПП-1 [95% ДІ]
(р-значення)
|
-1,67 [-2.00;-1,34]
(< 0,0001)
|
|
Постпрандіальний рівень глюкози через 2 години після прийому їжі (ммоль/л)*
|
|
|
|
Вихідний рівень (середнє значення)
|
13,60 |
13,78 |
|
Завершення дослідження (середнє значення)
|
9,68 |
12,59 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
-4,0 |
-1,11 |
|
Зміна порівняно з агоністом рецепторів до ГПП-1, визначена методом найменших квадратів (середнє значення) [95% ДІ] (р-значення)
|
-2,9 [-3,42; -2,28] (<0.0001)
|
| Середня маса тіла (кг) |
|
|
| Вихідний рівень (середнє значення) |
93,01 |
95,49 |
|
Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення)
|
1,89 |
-1,14 |
|
Порівняння з агоністом рецепторів ГПП-1 [95% ДІ] (р-значення)
|
-3,03 [2,417; 3,643]
(<0,0001)
|
* Постпрандіальний рівень глюкози через 2 години після прийому їжі мінус рівень глюкози перед прийомом їжі
Зображення — Середні рівні НЬАІс (%) на візитах протягом 26 тижнів лікування
Одночасне застосування препарату Соліква з інгібіторами натрій-глюкозного котранспортеру 2-го типу (інгібітори НЗКТГ-2)
Одночасне застосування препарату Соліква з інгібіторами НЗКТГ-2 підтверджується аналізом підгруп із трьох рандомізованих клінічних досліджень фази 3(119 пацієнтів, які отримували комбінацію інсуліну гларгіну/ліксисенатиду з фіксованим співвідношенням, які також отримували інгібітори НЗКТГ-2).
Одне дослідження, проведене в Європі й Північній Америці, включало в себе дані 26 пацієнтів (10,1%), які одночасно отримували комбінацію інсуліну гларгіну та ліксисенатиду з фіксованим співвідношенням, метформін та інгібітори НЗКТГ-2. Ще два дослідження фази 3 зі спеціалізованої японської програми клінічного розвитку, виконані на пацієнтах, які не досягли достатнього контролю глікемії на пероральних протидіабетичних препаратах, надали дані щодо 59 пацієнтів (22,7%) і 34 пацієнтів (21,1%), відповідно, які одночасно отримували інгібітори НЗКТГ-2 й комбінацію інсуліну гларгіну та ліксисенатиду з фіксованим співвідношенням.
Дані цих 3 досліджень показують, що початок застосування препарату Соліква у пацієнтів із недостатнім контролем лікуванням, які отримували інгібітори НЗКТГ-2, призводить до більш значного покращення рівнів НЬАІс порівняно з препаратами порівняння. У пацієнтів, які отримували інгібітори НЗКТГ-2, не було підвищеного ризику гіпоглікемії і значущих відмінностей в загальному профілі безпеки в порівнянні з тими, хто не отримував інгібітори НЗКТГ-2.
Дослідження з вивченням впливу на серцево-судинні події
Безпека інсуліну гларгіну та ліксисенатиду стосовно серцево-судинних подій вивчалась в рамках клінічних досліджень ORIGIN та ELIXA відповідно. Окремого дослідження з вивченням впливу препарату Соліква на серцево-судинні події не проводилось.
Інсулін гларгін. Дослідження зниження частоти серцево-судинних ускладнень при ініціальному застосуванні інсуліну гларгіну (дослідження ORIGIN) було відкритим рандомізованим дослідженням, в яке було включено 12 537 пацієнтів та в рамках якого порівнювалось лікування препаратом Лантус зі стандартним лікуванням > йа момент першого виникнення серйозного небажаного явища з боку серцево-судиЦпо'Г системи, у Серйозне небажане явище з боку серцево-судинної системи включало смерть вна'слідок- серцево-судинної події, нефатальний інфаркт міокарда та нефатальний інсульт. Медіана тривалості контрольного спостереження в рамках дослідження становила 6,2 років. Частота серйозних небажаних явищ з боку серцево-судинної системи в рамках дослідження ORIGIN була подібною між групою, що отримувала препарат Лантус, та групою, що отримувала стандартне лікування (відношення ризиків [95% ДІ] щодо серйозних небажаних явищ з боку серцево-судинної системи: 1,02 [0,94; 1,11]).
Ліксисенатид. Дослідження EL1XA було рандомізованим, подвійно-сліпим, плацебо- контрольованим, багатонаціональним дослідженням, в рамках якого здійснювалась оцінка серцево-судинних ускладнень під час лікування ліксисенатидом у пацієнтів з цукровим діабетом 2 типу (п = 6068) після нещодавно перенесеного гострого коронарного синдрому. Первинною комбінованою кінцевою точкою щодо ефективності був час до першого виникнення будь-якого з наступних небажаних явищ: смерть внаслідок серцево-судинної події, нефатальний інфаркт міокарда, нефатальний інсульт або госпіталізація з приводу нестабільної стенокардії. Медіана тривалості контрольного спостереження в рамках дослідження становила 25.8 та 25,7 місяців в групі ліксисенатиду та в групі плацебо відповідно.
Частота первинної кінцевої точки була подібною між групою ліксисенатиду (13,4%) та групою плацебо (13,2%): відношення ризиків для ліксисенатиду порівняно з плацебо становило 1,017 з асоційованим 2-стороннім 95% довірчим інтервалом (ДІ) від 0,886 до 1,168.
Фармакокінетика.
Абсорбція. Співвідношення інсулін гларгін/ліксисенатид суттєво не впливає на фармакокінетику інсуліну гларгіну та ліксисенатиду в препараті Соліква.
Після підшкірного введення комбінації інсулін гларгін/ліксисенатид у пацієнтів з цукровим діабетом 1 типу інсулін гларгін не демонстрував вираженого піку. Експозиція інсуліну гларгіну після введення комбінації інсулін гларгін І ліксисенатид становила 86- 88% від експозиції, яка відзначалась при окремих одночасних ін'єкціях інсуліну гларгіну та ліксисенатиду. Така відмінність не вважається клінічно значущою.
Після підшкірного введення комбінації інсулін гларгін/ліксисенатид у пацієнтів з цукровим діабетом 1 типу медіана tmax ліксисенатиду знаходилась в діапазоні від 2,5 до 3,0 годин. AUC була порівнянною, в той час як відзначалось незначне зниження Стах ліксисенатиду на 22-34% порівняно з Сmax, яка відзначалась при окремих одночасних ін'єкціях інсуліну гларгіну та ліксисенатиду; проте, таке зниження малоймовірно може бути клінічно значущим.
Клінічно значущі відмінності в швидкості абсорбції ліксисенатиду при його застосуванні у вигляді монотерапії після підшкірного введення в ділянку живота, дельтоподібного м’яза або стегна відсутні.
Розподіл. Ліксисенатид характеризується низьким (55 %) рівнем зв’язування з білками плазми людини. Передбачуваний об’єм розподілу ліксисенатиду після підшкірного введення комбінації інсулін гларгін/ліксисенатид (незв’язаний об’єм розподілу, Vz/F) становить приблизно 100 л. Передбачуваний об’єм розподілу інсулін}' гларгіну після підшкірного введення комбінації інсулін гларгін/ліксисенатид (об’єм розподілу в рівноважному стані, Vss/F) становить приблизно 1700 л.
Біотрансформація та елімінація. Результати дослідження з вивченням метаболізму в пацієнтів з цукровим діабетом, які отримували інсулін гларгін у вигляді монотерапії, свідчать про те, що інсулін гларгін швидко метаболізується на рівні карбоксильного кінця В-ланцюга з утворенням двох активних метаболітів - МІ (21 А-гліцин-інсулін) та М2 (21 А-гліцин-дез-ЗОВ-треонін-інсулін). У плазмі крові головною циркулюючою сполукою є метаболіт МІ. Фармакокінетичні та фармакодинамічні дані свідчать про те, що ефект підшкірної ін'єкції інсуліну гларгіну головним чином залежить від експозиції метаболіту МІ.
Як і всі пептиди, ліксисенатид виводиться шляхом клубочкової фільтрації з наступною . канальцевою реабсорбцією та подальшим метаболічним розщепленням до менших пептидів та амінокислот, які знову включаються в білковий метаболізм. Після багатократного введення у пацієнтів з цукровим діабетом 2 типу середній термінальний час напіввиведення становив приблизно 3 години, а середній уявний кліренс (CL/F) становив приблизно 35 л/год.
Особливі популяції пацієнтів.
Пацієнти з порушенням функції нирок. У пацієнтів з легким (кліренс креатиніну, розрахований за формулою Кокрофта-Голта. 60-90 мл/хв), помірним (кліренс креатиніну 30-60 мл/хв) та важким (кліренс креатиніну 15-30 мл/хв) порушенням функції нирок AUC ліксисенатиду зростала на 46%, 5Г% та 87% відповідно.
Застосування інсуліну гларгіну в пацієнтів з порушенням функції нирок не досліджувалось. Тим не менше, у пацієнтів з порушенням функції нирок потреба в інсуліні може бути зменшена внаслідок зниження метаболізму інсуліну.
Пацієнти з порушенням функції печінки. Оскільки ліксисенатид виводиться головним чином нирками, у пацієнтів з гострою або хронічною печінковою недостатністю жодних фармакокінетичних досліджень не проводилось. Вплив порушення функції печінки на фармакокінетику ліксисенатиду не передбачається.
Застосування інсуліну гларгіну в пацієнтів з цукровим діабетом та з порушенням функції печінки не досліджувалось. У пацієнтів з порушенням функції печінки потреба в інсуліні може бути зменшена у зв'язку зі зниженням здатності до глюконеогенезу та зниженням метаболізму інсуліну.
Вік, расова приналежність, стать та маса тіла.
Інсулін гларгін. Вплив віку, расової приналежності та статі на фармакокінетику інсуліну гларгіну не вивчався. За результатами аналізу підгруп, сформованих за віком, расовою приналежністю та статтю, в рамках контрольованих клінічних досліджень серед дорослих пацієнтів, які отримували інсулін гларгін (100 од/мл), жодних відмінностей стосовно безпеки та ефективності виявлено не було.
Ліксисенатид. Вік не має клінічно значущого впливу на фармакокінетику ліксисенатиду. В рамках дослідження фармакокінетики серед осіб похилого віку без цукрового діабету введення ліксисенатиду в дозі 20 мкг призводило до середнього підвищення AUC ліксисенатиду в цих осіб на 29% (11 учасників дослідження були віком від 65 до 74 років і 7 учасників дослідження - віком >75 років) порівняно з 18 особами віком від 18 до 45 років, що, ймовірно, пов'язано зі зниженням функції нирок у групі осіб похилого віку.
Етнічна приналежність не зумовлює клінічно значущого впливу на фармакокінетику ліксисенатиду, про що свідчать результати фармакокінетичних досліджень, проведених з участю пацієнтів європейської, японської та китайської національності.
Стать не має клінічно значущого впливу на фармакокінетику ліксисенатиду.
Маса тіла не має клінічно значущого впливу на AUC ліксисенатиду.
Імуногенність. За наявності антитіл до ліксисенатиду його експозиція та варіабельність його експозиції суттєво підвищуються, незалежно від рівня дозування.
Доклінічні дані з безпеки.
Жодних досліджень на тваринах із застосуванням комбінації інсуліну гларгіну та ліксисенатиду для оцінки токсичності при багатократному введенні, канцерогенезу, генотоксичності чи токсичного впливу на репродуктивну систему не проводилось.
Інсулін гларгін. Доклінічні дані, отримані у стандартних дослідженнях фармакологічної безпеки, токсичності при багатократному введенні, генотоксичності. канцерогенного потенціалу та токсичного впливу на репродуктивну систему, свідчать про відсутність будь-яких специфічних ризиків для людини при застосуванні інсуліну гларгіну.
Ліксисенатид. В рамках 2-річних досліджень канцерогенності при підшкірному введенні препарату у щурів та мишей спостерігалися нелегальні С-клітинні пухлини щитоподібної залози, які були розцінені як такі, що зумовлені негенотоксичним механізмом, опосередкованим рецепторами до GLP-1, до якого гризуни особливо чутливі. С-клітинна гіперплазія та аденома спостерігались у щурів на фоні застосування всіх досліджуваних доз, а максимальну дозу, при якій не відзначались небажані ефекти, визначити не вдалось. У мишей ці ефекти виникали при рівні експозиції, що у 9,3 рази перевищувар-експозицію в людей при застосуванні терапевтичних доз препарату. У мишей не спостерігалось С- клітинних карцином, а у щурів вони виникали при рівні експозиції, що приблизно у 900 разів перевищував експозицію у людей при застосуванні терапевтичних доз.
В рамках 2-річного дослідження канцерогенності при підшкірному введенні препарату у мишей відзначено З випадки аденокарциноми ендомстрію зі статистично значущим підвищенням частоти цього захворювання в групі застосування середніх доз препарату, які зумовлювали рівень експозиції, що перевищував експозицію в людей у 97 разів. Жодних ефектів, пов'язаних із застосуванням препарату, відзначено не було.
Результати досліджень на тваринах не свідчать про будь-який безпосередній шкідливий вплив препарату на фертильність самців та самок щурів. У собак, яким вводився ліксисенатид, спостерігались зворотні порушення в яечках та придатках яечок. У здорових чоловіків не відзначено жодного впливу препарату на сперматогенез, пов'язаного із застосуванням препарату.
У дослідженнях з вивченням впливу препарату на внутрішньоутробний розвиток у щурів на фоні всіх досліджуваних доз ліксисенатиду (при рівнях експозиції, що у 5 разів перевищували експозицію в людей) та у кролів при введенні високих доз препарату (при рівнях експозиції, що у 32 рази перевищували експозицію в людей) спостерігались вади розвитку, сповільнення росту плода, затримка осифікації та побічні ефекти з боку скелета. В обох моделях досліджуваних тварин відзначалась незначна токсична дія на материнський організм, що проявлялась у вигляді зменшення споживання їжі та зниження маси тіла. Ріст новонароджених щурят був сповільнений серед самців, які піддавались дії високих доз ліксисенатиду впродовж пізнього гестаційного періоду та лактації, з невеликим збільшенням смертності щурят.
