Один флакон препарату ФІБРИГА містить 1 г людського фібриногену. Після розведення з розчинником, 50 мл води для ін’єкцій, ФІБРИГА містить приблизно 20 мг/мл людського фібриногену.
Вміст білка, який здатний формувати згустки, визначається відповідно до Європейської фармакопеї за людським фібриногеном. Виготовляється з плазми людей-донорів.
Тромбоемболія
Існує ризик виникнення тромбозу при лікуванні пацієнтів із вродженим або набутим дефіцитом людського фібриногену, зокрема у разі застосування високих чи повторних доз. За пацієнтами, які отримують людський фібриноген, слід ретельно спостерігати щодо виникнення ознак або симптомів тромбозу.
У пацієнтів з ішемічною хворобою серця чи інфарктом міокарда в анамнезі, у пацієнтів із захворюваннями печінки, у пері- та постопераційних пацієнтів, у новонароджених та у пацієнтів із ризиком тромбоемболічних ускладнень або генералізованого тромбогеморагічного синдрому слід оцінити передбачувану користь лікування людським фібриногеном порівняно з ризиком тромбоемболічних ускладнень. Слід дотримуватися обережності та проводити ретельний моніторинг стану таких пацієнтів.
Набута гіпофібриногенемія пов’язана з низькими концентраціями всіх факторів згортання крові (а не тільки фібриногену) в плазмі крові та інгібіторами, тому слід розглянути лікування препаратами крові, що містять фактори згортання крові. Необхідний ретельний моніторинг системи згортання крові.
Алергічні чи анафілактичні реакції
Якщо виникають алергічні чи анафілактичні реакції, ін’єкцію/інфузію слід негайно припинити. У разі анафілактичного шоку слід провести звичайне медичне лікування від шоку.
Рівень натрію
Препарат ФІБРИГА містить до 132 мг (5,8 ммоль) натрію на флакон, що еквівалентно 6,6 % рекомендованого ВООЗ максимального щоденного прийому 2 г натрію для дорослого. Це потрібно враховувати пацієнтам, які перебувають на контрольованій безсольовій дієті.
Вірусна безпека
Звичайні заходи для запобігання інфекціям в результаті використання лікарських препаратів, виготовлених із крові або плазми крові людини, включають відбір донорів, скринінг крові окремих донорів і порцій донорської плазми на специфічні маркери інфекції та включення ефективних етапів виробничого процесу для інактивації/видалення вірусів. Незважаючи на це, коли вводяться лікарські препарати, виготовлені з крові або плазми крові людини, не можна повністю виключити можливість передачі збудників інфекції. Це також стосується невідомих або нових вірусів та інших патогенних мікроорганізмів.
Заходи, яких вживають, вважаються ефективними для вірусів із оболонкою, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В (ВГВ) і вірус гепатиту С (ВГС), а також для вірусу гепатиту А (ВГА) без оболонки. Заходи, яких вживають, можуть мати обмежену користь для вірусів без оболонки, таких як парвовірус В19. Інфекція парвовірусу В19 може бути небезпечною для вагітних жінок (інфікування плода) і для осіб із імунодефіцитом або підвищеним еритропоезом (наприклад, гемолітична анемія).
Слід розглянути відповідну вакцинацію (гепатити А і В) для пацієнтів, які постійно/повторно отримують препарати, виготовлені з плазми крові людини.
Настійно рекомендується кожного разу при введенні препарату ФІБРИГА пацієнту записувати назву та номер серії препарату для того, щоб можна було прослідкувати зв’язок між станом пацієнта і введенням препарату конкретної серії.
Імуногенність
У разі замісної терапії факторами згортанні крові при інших вроджених дефіцитах спостерігалися реакції з антитілами, але наразі немає даних щодо концентрату фібриногену.
Особливі запобіжні заходи стосовно утилізації та подальшої переробки
Загальні вказівки
Розведений розчин повинен бути майже безбарвним і трохи опалесцентним.
Не можна використовувати розчини, якщо вони мутні чи мають осад.
Розведення
1. Порошок (препарат ФІБРИГА) і розчинник (вода для ін’єкцій) у закритих флаконах нагріти до кімнатної температури. Кімнатну температуру слід також підтримувати під час приготування розчину. Якщо для нагрівання використовується водяна баня, потрібно стежити, щоб вода не потрапила на гумові кришки чи ковпачки флаконів. Температура водяної бані не повинна перевищувати + 37 °С.
2. Зняти ковпачки з флаконів, що містять порошок (препарат ФІБРИГА) і розчинник, щоб звільнити центральну частину пробки для інфузії. Просоченим спиртом тампоном протерти гумові пробки і залишити їх для висихання.
3. Зняти кришку з зовнішньої упаковки пристрою для переносу Осtajet. Для підтримання стерильності залишати/класти пристрій Осtajet в чистій зовнішній упаковці.
|
4. Взяти пристрій Осtajet у зовнішній упаковці та перевернути його над флаконом, що містить порошок (препарат ФІБРИГА). Помістити пристрій, що знаходиться в зовнішній упаковці, на центр флакона, що містить порошок, при цьому затискачі на безбарвні вістрі флакона з препаратом замкнуться. Тримаючи флакон, що містить порошок, обережно зняти зовнішню упаковку з пристрою Осtajet, намагаючись не торкнутися сінього вістря флакона з водою та залишити пристрій Осtajet міцно прикріпленим до флакона з концентратом (рисунок 1).
|

Рисунок 1
|
|
5. Утримуючи міцно флакон, що містить порошок (препарат ФІБРИГА), на рівній поверхні, перевернути флакон із розчинником та розмістити його по центру вістря флакона з водою. Проткнути гумову пробку флакона з розчинником синім пластмасовим вістрям пристрою Осtajet (рисунок 2).
|
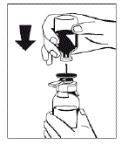
Рисунок 2
|
|
6. Видалити дистанційне кільце (рисунок 3) і притиснути вниз флакон із розчинником (рисунок 4). Розчинник потрапить у флакон, що містить порошок (препарат ФІБРИГА).
|
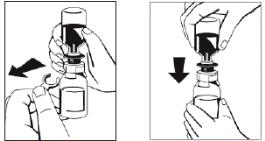 Рисунок 3 Рисунок 4 Рисунок 3 Рисунок 4
|
7. Коли розчинник повністю потрапить у флакон, обережно повертати флакон, що містить препарат, доки порошок повністю не розчиниться. Не слід струшувати флакон, щоб уникнути утворення піни. Порошок повинен повністю розчинитися протягом приблизно 5 хвилин. Зазвичай розчинення порошку триває не більше 30 хвилин. Якщо порошок не розчиниться протягом 30 хвилин, препарат слід утилізувати.
|
8. Повернути синій з’єднувач флакона з розчинником (можливі обидва напрямки), щоб наблизити/звести маркери положення, та видалити флакон із розчинником разом із вістрям флакона з водою (рисунок 5).
|
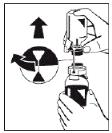 Рисунок 5 Рисунок 5
|
|
9. Закріпити шприц на фільтрі, що надається (рисунок 6), та приєднати фільтр до наконечника Луер-Лок пристрою Осtajet на флаконі, що містить порошок (рисунок 7).
Набрати розчин у шприц через фільтр (рисунок 8).
|
|
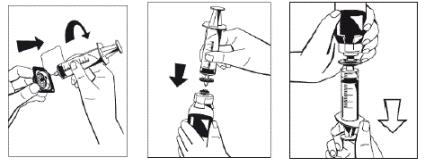
Рисунок 6 Рисунок 7 Рисунок 8
|
10. Від’єднати наповнений шприц від фільтра та викинути порожній флакон.
Рекомендується стандартний інфузійний набір для внутрішньовенного застосування розведеного розчину при кімнатній температурі.
Будь-який невикористаний препарат або відходи слід утилізувати згідно з вимогами місцевих органів влади.
