ІНСТРУКЦІЯ
для медичного застосування препарату
ФІРМАГОН
(FIRMAGON®)
Склад:
діюча речовина: дегарелікс;
1 флакон містить дегареліксу (у вигляді ацетату) 120 мг або 80 мг,
після розчинення концентрація становить 40 мг/мл або 20 мг/мл;
допоміжні речовини: маніт (Е 421);
1 попередньо наповнений шприц з розчинником містить 4,2 мл або 3,0 мл води для ін'єкцій.
Лікарська форма. Порошок для розчину для ін'єкцій.
Основні фізико-хімічні властивості:
порошок: білий або майже білий ліофілізат у вигляді коржа;
розчинник: прозора, безбарвна рідина.
Фармакотерапевтична група. Антагоністи гормонів та аналогічні засоби.
Код ATХ L02B X02.
Фармакологічні властивості.
Фармакодинаміка.
Дегарелікс – селективний антагоніст гонадотропін-рилізинг-гормону, що конкурентно й оборотно зв'язується з рецепторами гіпофізарного гонадотропін-рилізинг-гормону (ГнРГ), швидко знижуючи вивільнення гонадотропінів, лютеїнізуючого гормону (ЛГ) та фолікулостимулюючого гормону (ФСГ), і, таким чином, індукує секрецію тестостерону яєчками. Карцинома простати є андрогенчутливою та відповідає на лікування, яке видаляє джерело андрогенів. На відміну від агоністів ГнРГ, блокатори гонадотропін-рилізинг-гормону не індукують викид ЛГ з подальшим викидом тестостерону/стимуляцією росту пухлини, потенційним загостренням симптомів після початку терапії.
Одноразове введення 240 мг Фірмагону, після якого вводять щомісячну підтримуючу дозу
80 мг, швидко знижує рівень ЛГ, ФСГ і, отже, тестостерону. Концентрація дигідротестостерону (ДГТ) в плазмі знижується так, як і концентрація тестостерону.
Фірмагон ефективний щодо досягнення і підтримання пригнічення секреції тестостерону нижче рівня медичної кастрації 0,5 нг/мл. Підтримуюча доза 80 мг на місяць призводить до стійкого пригнічення секреції тестостерону у 97 % пацієнтів щонайменше протягом року.
Мікроколивань тестостерону після повторної ін'єкції в ході лікування Фірмагоном не спостерігалося. Середній рівень тестостерону після одного року лікування становив
0,087 нг/мл (інтерквартильний інтервал 0,06-0,15), N=167.
Результати підтверджуючого дослідження фази ІІІ
Ефективність і безпеку дегареліксу оцінювали в ході відкритого багатоцентрового рандомізованого дослідження на паралельних групах із застосуванням активного препарату контролю. В ході дослідження вивчали ефективність і безпеку двох різних місячних режимів дозування дегареліксу із початковою дозою 240 мг (40 мг/мл) та подальшим підшкірним введенням місячних доз 160 мг (40 мг/мл) або 80 мг (20 мг/мл) порівняно з місячним внутрішньом'язовим введенням 7,5 мг лейпрореліну пацієнтам із раком передміхурової залози, що потребує антиандрогенної терапії. Усього 620 пацієнтів було рандомізовано в одну з трьох груп лікування, з них 504 (81 %) завершили дослідження. У групі лікування дегареліксом 240/80 мг 41 (20 %) пацієнт вибув із дослідження порівняно з 32 (16 %) у групі, що отримувала лейпрорелін.
Із 610 пацієнтів, які проходили лікування:
· 31 % мали локалізований рак передміхурової залози;
· 29 % мали місцевопоширений рак передміхурової залози;
· 20 % мали рак передміхурової залози з метастазами;
· 7 % мали невизначений метастатичний статус;
· 13 % мали в анамнезі операцію або променеву терапію, спрямовану на вилікування, та наявне підвищення рівня простатичного специфічного антигену (ПСА).
Вихідні персональні дані були аналогічними в усіх групах. Середній вік становив 74 роки (діапазон від 47 до 98 років). Основною метою було продемонструвати ефективність дегареліксу щодо досягнення та підтримання супресії тестостерону на рівні, нижчому за 0,5 нг/мл, протягом 12 місяців лікування.
Було обрано найнижчу ефективну підтримуючу дозу дегареліксу 80 мг.
Досягнення рівня тестостерону в сироватці крові (T)≤0,5 нг/мл
Фірмагон ефективний для досягнення швидкої супресії тестостерону, див. таблицю 1.
Таблиця 1
Відсоток пацієнтів, які досягли рівня T≤0,5 нг/мл після початку лікування.
|
Період лікування
|
Дегарелікс 240/80 мг
|
Лейпрорелін 7,5 мг
|
|
День 1
|
52 %
|
0 %
|
|
День 3
|
96 %
|
0 %
|
|
День 7
|
99 %
|
1 %
|
|
День 14
|
100 %
|
18 %
|
|
День 28
|
100 %
|
100 %
|
Уникнення коливань тестостерону
Коливання було визначено як рівень тестостерону, що перевищує вихідний на ≥15 % протягом перших 2 тижнів.
У жодного з пацієнтів, які отримували лікування дегареліксом, не було коливань тестостерону; спостерігалося середнє зниження рівня тестостерону на 94 % на 3-й день. У більшості пацієнтів, які отримували лікування лейпрореліном, було коливання тестостерону; спостерігалося середнє підвищення рівня тестостерону на 65 % на 3-й день. Ця різниця була статистично значущою (p<0,001).
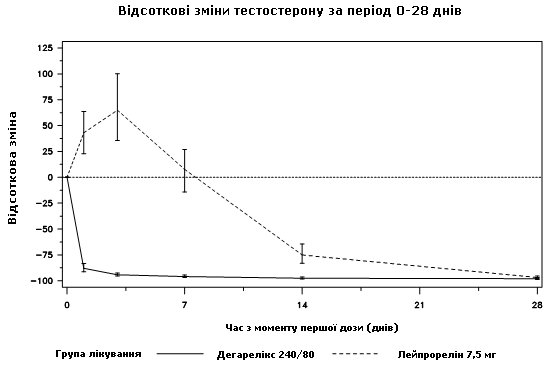
Діаграма 1. Відсоткова зміна тестостерону щодо вихідного рівня в групі лікування до 28-го дня (медіана з інтерквартильними зонами)
Первинною кінцевою точкою дослідження були рівні супресії тестостерону після року лікування дегареліксом або лейпрореліном. Клінічного результату для дегареліксу порівняно з лейпрореліном і антиандрогеном у початковій фазі лікування продемонстровано не було.
Відновлення тестостерону
Проведено дослідження за участю пацієнтів із підвищенням рівня ПСА після місцевої терапії (переважно радикальної простатектомії та променевої терапії), яким вводили Фірмагон протягом семи місяців після семимісячного періоду спостереження. Середній час до відновлення тестостерону (>0,5 нг/мл, що перевищує рівень після кастрації) після припинення лікування становив 112 днів (відрахунок від початку періоду спостереження, тобто 28 днів після останньої ін'єкції). Середній час до досягнення рівня тестостерону >1,5 нг/мл (що перевищує нижню межу нормального діапазону) становив 168 днів.
Довгостроковий вплив
Успішна реакція під час дослідження визначалась як досягнення медичної кастрації на 28-й день і її підтримання до 364-го дня, причому жодна разова концентрація тестостерону не перевищувала 0,5 нг/мл.
Таблиця 2
Сумарна ймовірність досягнення рівня тестостерону ≤0,5 нг/мл із 28-го по 364-й день
|
Назва препарату
Кількість пацієнтів
|
Дегарелікс 240/80 мг
N=207
|
Лейпрорелін 7,5 мг
N=201
|
|
К-сть пацієнтів із клінічною відповіддю
|
202
|
194
|
|
Частота відповіді
(довірчі інтервали)*
|
97,2 %
(93,5; 98,8 %)
|
96,4 %
(92,5; 98,2 %)
|
* Оцінки Каплана-Майєра в рамках групи
Зниження рівня ПСА
Розмір пухлин протягом клінічного дослідження безпосередньо не вимірювався, проте спостерігалася непряма відповідь доброякісних пухлин, про що показувало зниження середнього рівня ПСА на 95 % через 12 місяців застосування дегареліксу.
Середній рівень ПСА під час дослідження на вихідному рівні становив:
· для групи лікування дегареліксом 240/80 мг – 19,8 нг/мл (інтерквартильна зона: P25 9,4 нг/мл, P75 46,4 нг/мл);
· для групи лікування лейпрореліном 7,5 мг – 17,4 нг/мл (інтерквартильна зона: P25 8,4 нг/мл, P75 56,5 нг/мл).
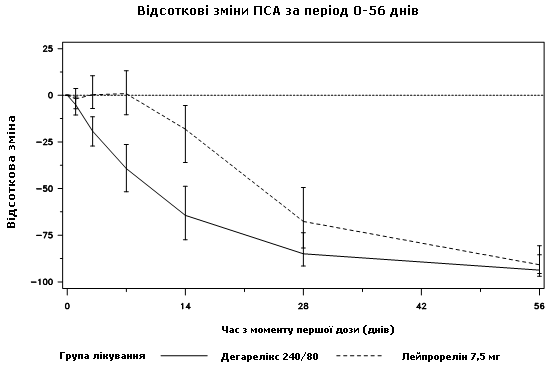
Діаграма 2. Відсоткова зміна ПСА щодо вихідного рівня в групі лікування до 56-го дня (медіана з інтерквартильними зонами)
Ця різниця була статистично значущою (p<0,001) для аналізу за змінними, заздалегідь передбаченими у плані, на 14-й і 28-день.
Рівні ПСА знижені на 64 % через два тижні після введення дегареліксу, на 85 % через один місяць, на 95 % через три місяці та лишилися пригніченими (близько 97 %) протягом одного року лікування.
Із 56-го по 364-й день значних розбіжностей між дегареліксом і препаратом порівняння у процентній зміні щодо вихідного рівня не було.
Вплив на об'єм передміхурової залози
В результаті 3-місячної терапії із застосуванням дегареліксу (режим дозування 240/80 мг) спостерігалося зниження об'єму передміхурової залози на 37 %, згідно з вимірами, отриманими за допомогою трансректального ультразвукового дослідження (ТРУЗД), у пацієнтів, які потребували гормональної терапії перед променевою терапією, та в пацієнтів-кандидатів на медичну кастрацію. Зниження об'єму передміхурової залози було аналогічним до результату, отриманого із застосуванням гозереліну й антиандрогенного захисту.
Вплив на інтервали QT/QTc
У ході підтверджуючих досліджень порівняння Фірмагону та лейпрореліну ЕКГ виконували періодично. Обидва варіанти терапії продемонстрували інтервали QT/QTc, що перевищували 450 мс, у близько 20 % пацієнтів. Порівняно з початковим значенням до кінця дослідження середнє збільшення довжини QTc для Фірмагону становило 12,0 мс, а для лейпрореліну – 16,7 мс.
Антитіла до дегареліксу
Розвиток антитіл до дегареліксу спостерігався у 10 % пацієнтів після лікування Фірмагоном протягом одного року та у 29 % пацієнтів після лікування Фірмагоном тривалістю до 5,5 року. Немає ознак того, що на ефективність або безпеку лікування Фірмагоном впливає утворення антитіл після лікування тривалістю до 5,5 року.
Фармакокінетика.
Абсорбція
Після підшкірного введення 240 мг дегареліксу при концентрації40 мг/мл пацієнтам із раком простати AUC0-28 днів була 635 (602–668) день*нг/мл, максимальна концентрація (Сmax) становила 66 (61–71) нг/мл та спостерігалась через tmax 40 (37–42) годин. Середні значення становили 11–12 нг/мл після першої дози та 11–16 нг/мл після підтримуючих доз 80 мг при концентрації 20 мг/мл. Сmax дегареліксу в плазмі знижується у двофазовому режимі із середнім періодом напіввиведення (t1/2) приблизно 29 днів для підтримуючої дози. Тривалий період напіввиведення після підшкірного введення є наслідком дуже повільного вивільнення дегареліксу з депо, що формується у місцях введення. Фармакокінетичні параметри препарату залежать від концентрації його у розчині для ін'єкцій. Таким чином, Сmax та біодоступність мають тенденцію до зниження зі зростанням концентрації, тому не слід застосовувати інші, ніж призначено, концентрації.
Розподіл
Об'єм розподілу у здорового добровольця літнього віку становив приблизно 1 л/кг. Зв'язування з білками плазми становило приблизно 90 %.
Mетаболізм
Дегарелікс є суб'єктом звичайної деградації пептидів під час проходження його через гепатобіліарну систему, більша частина його виділяється у вигляді пептидних фрагментів з калом. Після підшкірного введення фармакологічно активних метаболітів у плазмі крові не виявлено. Дослідження invitro показали, що дегарелікс не є субстратом для системи цитохрому CYP450 людини.
Виведення
У здорових чоловіків приблизно 20–30 % однієї внутрішньовенної дози дегареліксу виводиться нирками. Припускають, що 70–80 % виводиться через гепатобіліарну систему. Кліренс дегареліксу при введенні одноразової внутрішньовенної дози (0,864-49,4 мкг/кг) у літніх здорових чоловіків становив 35–50 мл/год/кг маси тіла.
Окремі групи пацієнтів
Пацієнти з порушеннями функцій нирок
За участю пацієнтів з порушеннями функцій нирок фармакокінетичні дослідження не проводилися. Нирками виводиться в незміненому вигляді усього 20–30 % введеної дози дегареліксу. Популяційний аналіз фармакокінетики за даними дослідження фази ІІІ показав, що кліренс дегареліксу у пацієнтів із нирковою недостатністю від легкого до помірного ступеня тяжкості знижується на 23 %, тому підбір дози пацієнтам із нирковою недостатністю від легкого до помірного ступеня тяжкості не рекомендується. Дані про пацієнтів з тяжкою нирковою недостатністю обмежені, тому щодо таких пацієнтів слід дотримуватись особливої обережності.
Пацієнти з порушеннями функцій печінки
Дегарелікс вивчався в ході фармакокінетичного дослідження за участю пацієнтів із порушеннями функцій печінки від легкого до помірного ступеня тяжкості. Ознак посиленого впливу в пацієнтів із порушеннями функцій печінки порівняно зі здоровими добровольцями не спостерігалося. Підбір дози пацієнтам з печінковою недостатністю від легкого до помірного ступеня тяжкості не потрібний. Застосування пацієнтам з тяжкою печінковою недостатністю не вивчалося, тому щодо цієї групи пацієнтів слід дотримуватись застережних заходів.
Клінічні характеристики.
Показання. Лікування дорослих чоловіків із розповсюдженим гормонозалежним раком передміхурової залози.
Протипоказання. Гіперчутливість до дегареліксу або до будь-якого іншого компонента препарату.
Фірмагон не призначений для застосування жінкам та дітям.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження взаємодії з іншими лікарськими засобами не проводилися.
Оскільки терапія депривацією андрогенами може подовжувати інтервал QTc, одночасне застосування Фірмагону з препаратами, які подовжують інтервал QTc або здатні індукувати веретеноподібну шлуночкову тахікардію, такими як антиаритмічні засоби класу ІА (хінідин, дизопірамід) або класу ІІІ (аміодарон, соталол, дофетилід, ібутилід), а також метадон, моксифлоксацин, антипсихотичні засоби, потребує ретельної оцінки.
Дегарелікс не є субстратом для системи цитохрому CYP450 у людини і не активує та не інгібує CYP1A2, CYP2В6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 або CYP3A4/5 у будь-яких значущих кількостях invitro. Крім того, дегарелікс не взаємодіє з будь-якими відповідними транспортерами виведення та засвоєння лікарських засобів.
Таким чином, клінічно значущі фармакокінетичні взаємодії з іншими лікарськими засобами в метаболізмі, що пов’язаний з цими ізоферментами, малоймовірні.
Особливості застосування.
Фірмагон призначений лише для підшкірного введення.
Вплив на інтервал QT/QTc
Тривала андрогенна деприваційна терапія може спричинити збільшення інтервалу QT.
У ході досліджень щодо порівняння Фірмагону та лейпрореліну ЕКГ виконували щомісячно. Обидва режими терапії виявили інтервал QT та QTc, який перевищував 450 мс у 20 % пацієнтів та 500 мс – у 1 та 2 % пацієнтів відповідно, які застосовували дегарелікс та лейпрорелін.
Дія Фірмагону не досліджувалась у пацієнтів з інтервалом QT більше 450 мс, у пацієнтів з веретеноподібною шлуночковою тахікардією або ризиком ії виникнення, також у пацієнтів, які отримують супутні лікарські засоби, що можуть збільшити інтервал QT. Таким чином, у таких пацієнтів співвідношенння ризик/користь для Фірмагону потребує ретельної оцінки.
Детальне дослідження QT продемонструвало, що власний вплив дегареліксу на інтервал QT/QTc відсутній.
Ураження печінки
Пацієнти з відомими або підозрюваними захворюваннями печінки не брали участі в довгострокових клінічних дослідженнях із застосуванням дегареліксу. Відмічалось незначне підвищення рівня АСТ та АЛТ, що минає та не супроводжується підвищенням рівня білірубіну або клінічними симптомами. Моніторинг функції печінки протягом терапії доцільний у пацієнтів з відомими або припустимими порушеннями з боку печінки. Фармакокінетика дегареліксу досліджувалася після одноразового внутрішньовенного введення у пацієнтів із ураженням печінки від легкого до помірного ступеня.
Ураження нирок
Слід з обережністю призначати препарат пацієнтам з тяжкими порушеннями функцій нирок.
Гіперчутливість
Фірмагон не вивчався у пацієнтів з тяжкою нелікованою астмою в анамнезі, анафілактичними реакціями, тяжкою кропив'янкою, ангіоневротичним набряком.
Зміна щільності кісток
У медичній літературі відмічалося зниження щільності кісток у пацієнтів, які перенесли орхектомію або отримували лікування агоністами ГнРГ, що свідчить про вплив супресії тестостерону у чоловіків на щільність кісткової тканини. Щільності кісткової тканини протягом лікування Фірмагоном не вимірювали.
Толерантність до глюкози
У пацієнтів, яким було виконано орхектомію, а також у тих, хто отримував лікування агоністами ГнРГ, спостерігали зниження толерантності до глюкози. Можливий розвиток або ускладнення перебігу діабету. Таким чином, необхідний більш частий моніторинг рівня глюкози крові у пацієнтів-діабетиків при прийомі деприваційної терапії. Ефекту Фірмагону на рівні інсуліну та глюкози не вивчали.
Серцево-судинні захворювання
В медичній літературі повідомлялося про такі серцево-судинні захворювання як інсульт та інфаркт міокарду у пацієнтів з андрогенною деприваційною терапією. Тому всі серцево-судинні фактори ризику повинні бути враховані.
Фертильність
Фірмагон може пригнічувати чоловічу фертильність доти поки є пригнічення секреції тестостерону.
Застосування у період вагітності або годування груддю.
Препарат не застосовують жінкам.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Фірмагон не має або має незначний вплив на керування транспортними засобами і роботу з механізмами. Втомлюваність та запаморочення є найбільш частими побічними реакціями, що могли б вплинути на керування транспортними засобами і на здатність працювати з механізмами.
Спосіб застосування та дози.
Дозування
|
Початкова доза
|
Підтримуюча доза 1 раз на місяць
|
|
240 мг у вигляді двох підшкірних ін'єкцій по 120 мг кожна
|
80 мг у вигляді підшкірної ін'єкції
|
Першу підтримуючу дозу потрібно ввести через 1 місяць після введення початкової дози.
Tерапевтичний ефект Фірмагону слід моніторувати за клінічними параметрами і шляхом вимірювання рівня ПСА в сироватці крові. Клінічні дослідження продемонстрували, що супресія тестостерону (Т) відбувається одразу ж після введення початкової дози: у 96 % пацієнтів, рівень тестостерону в сироватці яких відповідає рівню після медичної кастрації (T≤0,5 нг/мл), – через три дні та у 100 % – через один місяць. Довгострокове лікування терміном до 1 року із застосуванням підтримуючої дози демонструє, що 97 % пацієнтів мають стабільний пригнічений рівень тестостерону (T≤0,5 нг/мл).
Якщо клінічний ефект недостатній, слід переконатися, що рівень сироваткового тестостерону знижений достатньо.
Оскільки Фірмагон не індукує підвищення рівня тестостерону, немає необхідності у призначенні антиандрогенних препаратів як захисту від викиду тестостерону на початку терапії.
Введення
Фірмагон призначений лише для підшкірного введення, і його не можна вводити внутрішньовенно. Внутрішньом'язове введення не вивчалося, тому не рекомендується.
Препарат призначають у вигляді підшкірних ін'єкцій у ділянку живота. Місце ін'єкції слід періодично змінювати. Ін'єкції потрібно здійснювати у ділянки, які не стискаються одягом (зокрема не вводити в ділянку пояса на талії або ременя) і не надто близько до ребер.
Підбір дози для окремих груп пацієнтів
Пацієнти літнього віку, з печінковою і нирковою недостатністю
Немає необхідності підбору дози пацієнтам літнього віку або за наявності незначного порушення функції печінки і нирок. Застосування препарату у разі тяжкої ниркової і печінкової недостатності не вивчалося, тому в таких випадках слід дотримуватись особливої обережності.
Правила введення препарату
Введення інших, ніж призначено, концентрацій не рекомендується, оскільки концентрація впливає на утворення депо.
Розведений розчин повинен бути прозорим, без нерозчинених частинок.
Застереження
Не слід струшувати флакони.
Фірмагон 120 мг
Оскільки упаковка містить 2 флакони з порошком і 2 попередньо наповнених розчинником шприци, процедуру розчинення потрібно повторити двічі.
|
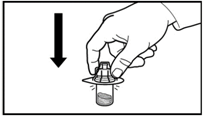
1. Зніміть кришку з флакона. Прикріпіть адаптер на флакон з порошком, натискуючи на адаптер вниз, поки голка не простромить гумову пробку та адаптер не стане в зазначене місце.
|
|
2. Підготуйте попередньо заповнений шприц шляхом приєднання стержня поршня.
|
|
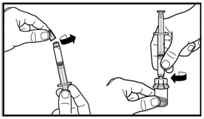
3. Зніміть ковпачок з попередньо наповненого шприца. Прикріпіть шприц до флакона з порошком та нагвинтіть його на адаптер. Введіть весь розчинник у флакон з порошком.
|
|
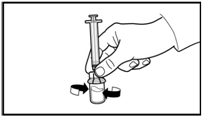
4. Не роз'єднуючи шприц з адаптером, м'яко похитуйте їх доти, доки рідина не стане прозорою, без домішок та часточок, що не розчинилися. Якщо порошок пристав до стінки флакона над рівнем рідини, можна злегка нахилити флакон.
Не струшуйте флакон, щоб не спричинити утворення піни.
Допускається кільце із невеликих пухирців повітря на поверхні рідини. Процедура розчинення зазвичай триває кілька хвилин, але в деяких випадках може займати до 15 хвилин.
|
|
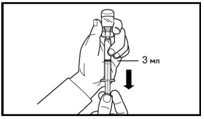
5. Поверніть флакон догори дном та наберіть препарат до лінії позначки в шприц для ін'єкцій.
Завжди перевіряйте точність набраного об'єму та відсутність будь-яких повітряних пухирців.
|
|
6. Від'єднайте шприц від адаптера флакона та прикріпіть до шприца голку для глибокого підшкірного введення.
|
|
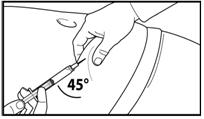
7. Зробіть глибоку підшкірну ін'єкцію.
Для цього зберіть шкіру живота у складку, злегка підніміть підшкірну тканину і введіть голку глибоко під кутом не менше 45 градусів.
Введіть повільно 3 мл Фірмагону 120 мг, одразу після розведення.
|
|
8. Не слід робити ін'єкції в місцях, які будуть піддаватися тиску, наприклад у ділянку, що знаходиться під ременем або поясом або близько до ребер.
Не вводьте безпосередньо у вену. Обережно потягніть поршень на себе, щоб переконатися у відсутності крові у шприці. При появі крові препарат не можна застосовувати далі. Припиніть процедуру та видаліть шприц з голкою і препаратом (розведіть нову дозу для пацієнта).
|
|
9. Слід повторити процедуру розведення для другої дози. Виберіть інше місце для ін'єкції та введіть наступні 3 мл розведеного препарату відразу після розведення.
|
Фірмагон 80 мг
Упаковка містить 1 флакон з порошком і 1 попередньо наповнений шприц з розчинником для приготування розчину для підшкірної ін'єкції.
|

1. Зніміть кришку з флакона. Прикріпіть адаптер на флакон з порошком, натискуючи на адаптер вниз, поки голка не простромить гумову пробку та адаптер не стане в зазначене місце.
|
|
2. Підготуйте попередньо заповнений шприц шляхом приєднання стержня поршня.
|
|

3. Зніміть ковпачок з попередньо наповненого шприца. Прикріпіть шприц до флакона з порошком та нагвинтіть його на адаптер. Введіть весь розчинник у флакон з порошком.
|
|

4. Не роз'єднуючи шприц з адаптером, м'яко похитуйте доти, доки рідина не стане прозорою, без домішок та часточок, що не розчинилися. Якщо порошок пристав до стінки флакона над рівнем рідини, можна злегка нахилити флакон.
Не струшуйте флакон, щоб не спричинити утворення піни.
Допускається кільце із невеликих пухирців повітря на поверхні рідини. Процедура розчинення зазвичай триває кілька хвилин, але в деяких випадках може займати до 15 хвилин.
|
|
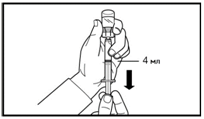
5. Поверніть флакон догори дном та наберіть препарат до лінії позначки в шприц для ін'єкцій.
Завжди перевіряйте точність набраного об'єму та відсутність будь-яких повітряних пухирців.
|
|
6. Від'єднайте шприц від адаптера флакона та прикріпіть до шприца голку для глибокого підшкірного введення.
|
|

7. Зробіть глибоку підшкірну ін'єкцію.
Для цього зберіть шкіру живота у складку, злегка підніміть підшкірну тканину і введіть голку глибоко під кутом не менше 45 градусів.
Введіть повільно 4 мл Фірмагону 80 мг одразу після розведення.
|
|
8. Не слід робити ін'єкції в місцях, які будуть піддаватися тиску, наприклад у ділянку під ременем або поясом або близько до ребер.
Не вводьте безпосередньо у вену. Обережно потягніть поршень на себе, щоб переконатися у відсутності крові у шприці. При появі крові препарат не можна застосовувати далі. Припиніть процедуру та видаліть шприц з голкою і препаратом (розведіть нову дозу для пацієнта).
|
Після розчинення препарат слід негайно ввести. Хімічна і фізична стабільність розведеного розчину зберігається протягом 2 годин після розведення.
Діти. Препарат не застосовують дітям.
Передозування.
Клінічний досвід щодо наслідків гострого передозування Фірмагону відсутній.
У кожному випадку передозування за пацієнтом слід встановити спостереження, а за необхідності – проводити підтримуючу терапію.
Побічні реакції.
Побічні реакції, що найбільш часто спостерігалися під час терапії дегареліксом у ході підтверджуючого дослідження фази III (N = 409), були або пов'язані з очікуваними фізіологічними ефектами пригнічення секреції тестостерону, у тому числі з припливами та збільшенням маси тіла (виявлено відповідно у 25 % і 7 % пацієнтів, які отримували лікування протягом одного року), або були побічними ефектами в місці ін'єкції. Транзиторний озноб, гарячка або грипоподібний стан були зареєстровані протягом кількох годин після прийому препарату (в 3 %, 2 % і 1 % пацієнтів відповідно).
Побічні реакції в місці ін'єкції, які в основному проявлялися болем та еритемою, виявлені у 28 % і 17 % пацієнтів відповідно, менш частими були набряки (6 %), індурація (4 %) та утворення вузликів (3 %). Ці події спостерігалися найчастіше на тлі стартової дози, тоді як під час проведення підтримуючої терапії дозою 80 мг частота цих подій на 100 ін'єкцій становила 3 для болю і < 1 для еритеми, набряку, індурації та утворення вузликів. Вказані події були в основному транзиторними, від легкого до помірного ступеня вираженості та дуже рідко призводили до переривання лікування (< 1 %). Серйозні реакції в місці ін’єкції, такі як інфікування місця ін’єкції, абсцес або некроз в місці ін’єкції, що вимагають хірургічного лікування або дренування, з’являлися дуже рідко.
Побічні ефекти розподілені за системами органів та частотою виникнення: дуже поширені (≥1/10); поширені (≥1/100 до <1/10); непоширені (≥1/1000 до <1/100); рідкісні (≥1/10000 до <1/1000).
Частота побічних реакцій, про які повідомлялося у 1259 пацієнтів, які проходили лікування, із загальної кількості 1781 пацієнто-років (дослідження фаз ІІ і ІІІ) та з постмаркетингового дослідження.
Розлади з боку кровіі лімфатичноїсистеми. Поширені: анемія*. Рідкісні: нейтропенічна гарячка.
Розлади з бокуімунної системи. Непоширені: гіперчутливість. Рідкісні: анафілактичні реакції.
Розлади метаболізму. Поширені: збільшення маси тіла*. Непоширені: гіперглікемія/ цукровий діабет, підвищення рівня холестерину, зниження маси тіла, зниження апетиту, зміна рівня кальцію в крові.
Розлади з боку нервової системи. Поширені: запаморочення, головний біль, безсоння. Непоширені: гіпестезія, психічні порушення, депресія, зниження лібідо*.
Розлади з боку органів зору. Непоширені: зниження гостроти зору.
Розлади з боку серця. Непоширені: серцеві аритмії (у тому числі фібриляція передсердь), серцебиття, подовження інтервалу QT*. Рідкісні: інфаркт міокарда, серцева недостатність.
Порушення з боку судин. Дуже поширені: припливи*. Непоширені:артеріальна гіпертензія, вазовагальна реакція (включаючи гіпотензію).
Розлади з боку дихальної системи та органів грудної клітки. Непоширені: диспное.
Розлади з бокушлунково-кишкового тракту. Поширені: нудота, діарея. Непоширені: запор, блювання, дискомфорт у ділянці живота, абдомінальний біль, сухість у роті.
Розлади з боку гепатобіліарної системи. Поширені: підвищення рівня печінкових трансаміназ. Непоширені: підвищення рівня білірубіну, підвищення рівня лужної фосфатази.
Розлади з боку шкіри і підшкірної клітковини. Поширені: гіпергідроз (у тому числі нічна пітливість)*, висипання. Непоширені: кропив'янка, свербіж, вузликове висипання, алопеція, еритема.
Розлади з боку кістково-м'язової системи та сполучної тканини. Поширені: кістково-м'язовий біль та дискомфорт. Непоширені: остеопороз/остеопенія, артралгія, м'язова слабкість, м'язові спазми, набряк/скутість суглобів.
Розлади з боку сечовидільної системи. Непоширені: полакіурія, невідкладний позив до сечовипускання, дизурія, ніктурія, ниркова недостатність, нетримання сечі.
Розлади з боку репродуктивної системи і молочних залоз. Поширені: еректильна дисфункція*, атрофія яєчок*, гінекомастія*. Непоширені: тазовий біль, тестикулярний біль, біль у грудях, подразнення в ділянці статевих органів, порушення еякуляції.
Загальні розлади та реакції в місці введення. Дуже поширені: реакції у місці ін'єкції. Поширені: озноб, гарячка, підвищена втомлюваність*, грипоподібний стан. Непоширені: периферичний набряк, нездужання.
*Фізіологічні наслідки пригнічення секреції тестостерону.
За даними постмаркетингового періоду були рідкісні повідомлення про реакції гіперчутливості, включаючи анафілаксію, кропивʼянку та ангіоневротичний набряк.
Змінилабораторнихпоказників.
Зміни лабораторних показників розглядалися протягом одного року лікування в підтверджуючому дослідженні фази III (N = 409) і були в тому ж діапазоні як для дегареліксу так і для ГнРГ-агоніста лейпрореліну, який був використаний як препарат порівняння. Суттєве зростання (в 3 рази вище верхньої межі норми) печінкових трансаміназ (АЛТ, АСТ і ГГТ) на тлі лікування обома препаратами було помічено в 2-6 % пацієнтів з нормальними значеннями до лікування. Суттєве зменшення значення гематологічних показників – гематокриту (≤0,37) і гемоглобіну (≤115 г/л) – було відмічено відповідно в 40 % і 13-15 % пацієнтів з початково нормальними показниками. Поки невідомо, якою мірою це зменшення значення гематологічних показників було обумовлено наявністю раку простати і якою мірою це було наслідком андрогенної блокади. Відхилення від норми рівня калію (≥ 5,8 ммоль/л), креатиніну (≥ 177 мкмоль/л) та сечовини (≥ 10,7 ммоль/л) у пацієнтів з нормальними значеннями до початку лікування було відмічено в 6 %, 2 % і 15 % пацієнтів, які отримували дегарелікс, та 3 %, 2 % і 14 % пацієнтів, які отримували лейпрорелін, відповідно.
ЗміниЕКГ.
Зміни ЕКГ, які спостерігали протягом одного року лікування в підтверджуючому дослідженні фази III (N = 409), були в тому ж діапазоні як для дегареліксу, так і для ГнРГ-агоніста лейпрореліну, який використовували як препарат порівняння. У трьох (
Відсутність впливу власне дегареліксу на серцеву реполяризацію (QTcF), частоту серцевих скорочень, АВ-провідність, серцеву деполяризацію або ж морфологію T- або U-хвиль було підтверджено в ході ретельного QT-дослідження у здорових добровольців (N=80), які отримували внутрішньовенну інфузію дегареліксу протягом 60 хв, із досягненням середнього значення Cmax 222 нг/мл, що приблизно у 3-4 рази більше за значення Cmax, отримане при лікуванні раку передміхурової залози.
Термін придатності. 3 роки.
Не застосовувати після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.Зберігати в оригінальній упаковці при температурі не вище 25 °С. Не заморожувати. Зберігати в недоступному для дітей місці.
Несумісність.
Через відсутність досліджень сумісності цей препарат не слід змішувати з іншими препаратами.
Упаковка. 1 флакон з порошком по 80 мг у комплекті з 1 попередньо наповненим шприцом з розчинником по 5 мл (з маркуванням 4,0 мл та об'ємом наповнення 4,2 мл), 1 адаптером для флакона, 1 голкою для введення та 1 стержнем поршня в картонній упаковці.
2 флакони з порошком по 120 мг у комплекті з 2 попередньо наповненими шприцами з розчинником по 5 мл (з маркуванням 3,0 мл та об'ємом наповнення 3,0 мл), 2 адаптерами для флакона, 2 голками для введення та 2 стержнями поршня в картонній упаковці.
Категорія відпуску. За рецептом.
Виробник.
Феррінг ГмбХ, Німеччина/Ferring GmbH, Germany.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Вітланд 11, Постфаш 21 45, Д-24109 Кіль, Німеччина/Wittland 11, Postfach 21 45, D-24109 Kiel, Germany.
