ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕЛОНВА
(ЕLONVA®)
Склад:
діюча речовина: корифолітропін альфа;
1 наповнений шприц (0,5 мл) містить 100 мкг або 150 мкг корифолітропіну альфа;
допоміжні речовини: натрію цитрат, цукроза, полісорбат 20, метіонін, натрію гідроксид та/або кислота хлористоводнева концентрована, вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий водний розчин.
Фармакотерапевтична група. Гонадотропні та інші стимулятори овуляції.Корифолітропін альфа.Код АТX G03G A09.
Фармакологічні властивості.
Фармакодинаміка.
Корифолітропін альфа розроблений як препарат тривалої дії, який ініціює стимуляцію овуляції, з таким же фармакодинамічним профілем, як у рекомбінантного фолікулостимулюючого гормону (рФСГ), але з помітно подовженою тривалістю активності ФСГ. Внаслідок його здатності ініціювати та підтримувати ріст численних фолікулів протягом цілого тижня одноразова підшкірна ін’єкція рекомендованої дози препарату Елонва може замінити перші 7 ін’єкцій будь-якого щоденного рекомбінантного ФСГ-препарату в циклі лікування шляхом контрольованої стимуляції яєчників (КСЯ). Велика тривалість активності ФСГ досягнута додаванням до бета-ланцюга людського ФСГ карбоксикінцевого пептиду бета-субодиниці людського хоріонічного гонадотропіну (лХГ).
Корифолітропін альфа не демонструє ніякої ЛГ/лХГ активності.
Фармакокінетика.
Фармакокінетичні параметри корифолітропіну альфа оцінювалися після підшкірного введення у жінок, що проходять цикл лікування КСЯ.
Через тривалий період напіввиведення після введення рекомендованої дози концентрації корифолітропіну альфа в сироватці крові достатні для підтримання росту численних фолікулів протягом цілого тижня. Це виправдовує заміну одноразовою підшкірною ін’єкцією препарату Елонва при КСЯ перші 7 ін’єкцій щоденного рФСГ для розвитку численних фолікулів та вагітності в програмі Допоміжних репродуктивних технологій(ДРТ) (див. розділ «Спосіб застосування та дози»).
Фактором, що визначає дозу корифолітропіну альфа, є маса тіла. Дія корифолітропіну альфа після одноразової підшкірної ін’єкції становить 665 годин*нг/мл (AUC, 426-1037 годин*нг/мл1) і є аналогічною після введення 100 мкг корифолітропіну альфа жінкам з масою тіла менш ніж або дорівнює 60 кг і 150 мкг корифолітропіну альфа жінкам з масою тіла більш ніж 60 кг.
Абсорбція
Після одноразової підшкірної ін’єкції препарату Елонва максимальна концентрація корифолітропіну альфа в сироватці крові становить 4,24 нг/мл (2,49-7,21 нг/мл1) та досягається через 44 години (35-57 годин1). Абсолютна біодоступність становить 58% (48-70%1).
Розподіл
Такі характеристики як розподіл, метаболізм та виведення корифолітропіну альфа дуже подібні до відповідних характеристик інших гонадотропінів, таких як ФСГ, лХГ та ЛГ. Після абсорбції в кров корифолітропін альфа розподіляється, головним чином, в яєчниках та нирках. Об’єм розподілу при стабільній концентрації дорівнює 9,2 л (6,5-13,1 л1). Вплив корифолітропіну альфа зростає пропорційно зростанню дози в межах від 60 до 240 мкг.
Виведення
Корифолітропін альфа має період напіввиведення, що становить 70 годин (59-82 години1) та кліренс 0,13 л/годину (0,10-0,18 л/годину1). Виведення корифолітропіну альфа відбувається переважно нирками та може погіршуватися у пацієнтів із нирковою недостатністю (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
1 Прогнозований рівень для 90% пацієнтів.
Інші окремі групи пацієнтів
Порушення функції печінки
Хоча дані про пацієнток із порушеннями функції печінки відсутні, малоймовірно, що погіршення функції печінки чинить вплив на фармакокінетичний профіль корифолітропіну альфа.
Клінічні характеристики.
Показання.
Контрольована стимуляція яєчників (КСЯ) у поєднанні з антагоністом гонадотропін-рилізинг гормону (ГРГ) для розвитку чисельних фолікулів у жінок, які беруть участь у програмі Допоміжних репродуктивних технологій (ДРТ).
Протипоказання.
· Підвищена чутливість до активної речовини або до будь-якої з допоміжних речовин.
· Вагітність (див. розділ «Застосування у період вагітності або годування груддю»).
· Пухлини яєчників, молочних залоз, матки, гіпофіза або гіпоталамуса.
· Патологічна (не менструальна) вагінальна кровотеча без відомої/діагностованої етіології.
· Первинна дисфункція яєчників.
· Кісти яєчників або збільшення яєчників.
· Синдром гіперстимуляції яєчників (СГСЯ) в анамнезі.
· Попередній цикл КСЯ, що призвів до утворення більш ніж 30 фолікулів розміром ≥11 мм, які вимірюються при ультразвуковому дослідженні.
· Кількість базальних антральних фолікул >20.
· Фіброзні пухлини матки, несумісні з вагітністю.
· Пороки розвитку репродуктивних органів, несумісні з вагітністю.
· Синдром полікістозу яєчників (СПЯ).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження взаємодії препарату Елонва з іншими лікарськими засобами не проводилися. Оскільки корифолітропін альфа не є субстратом цитохромних Р450 ензимів, не очікується жодної взаємодії з іншими лікарськими засобами.
Елонва може призвести до отримання хибного позитивного результату лХГ тесту на вагітність, у випадку якщо тест проведений під час ДРТ циклу стимуляції яєчників. Це може бути пов’язано з крос-реактивністю деяких лХГ тестів на вагітність з карбокси-термінальним пептидом бета субодиниці препарату Елонва.
Особливості застосування.
Оцінка безпліддя перед початком лікування
Перед початком лікування повинні бути встановлені причини безплідності у пари. Зокрема, жінку необхідно продіагностувати відносно гіпотиреозу, адренокортикальної недостатності, гіперпролактинемії, пухлин гіпофіза або гіпоталамуса, а також попередньо проведеного відповідного специфічного лікування. Також перед початком лікування препаратом Елонва необхідно оцінити медичні стани, при яких протипоказана вагітність.
Дозування протягом циклу стимуляції
Препарат Елонва призначений для введення тільки у вигляді одноразової підшкірної ін’єкції. Не можна робити додаткових ін’єкцій препарату протягом одного і того ж циклу лікування (див. розділ «Спосіб застосування та дози»).
До 8-го дня стимуляції після застосування препарату Елонва не слід додатково вводити препарати, що містять рФСГ (див. також розділ «Спосіб застосування та дози»).
Порушення функції нирок
У пацієнток зі слабкою, помірною або тяжкою нирковою недостатністю екскреція корифолітропіну альфа може бути знижена (див. розділ «Спосіб застосування та дози» та підрозділ «Фармакокінетика»), тому застосування препарату таким пацієнтам не рекомендується.
Нерекомендоване застосування з агоністом гонадотропін-рилізинг-гормону
Дані про застосування препарату Елонва в поєднанні з агоністом ГРГ є обмеженими. Результати дослідження дають можливість припустити підвищену реакцію яєчників, ніж при поєднанні з антагоністом ГРГ. Тому препарат у поєднанні з агоністом ГРГ застосовувати не рекомендується (див. розділ «Спосіб застосування та дози»).
Синдром гіперстимуляції яєчників (СГСЯ)
СГСЯ відрізняється від простого збільшення яєчників. Клінічними ознаками та симптомами слабкого та помірного СГСЯ є біль у животі, нудота, діарея, збільшення яєчників від незначного до помірного та кісти яєчників. СГСЯ тяжкого ступеня може становити загрозу для життя. Клінічні ознаки та симптоми тяжкого СГСЯ - це великі кісти яєчників, гострий абдомінальний біль, асцит, плевральний випіт, гідроторакс, диспное, олігурія, гематологічні відхилення та збільшення маси тіла. Інколи одночасно з СГСЯ можуть мати місце венозні або артеріальні тромбоемболічні розлади. Також повідомлялось про зв’язок СГСЯ та транзиторних патологічних змін функціональних проб печінки, що вказують на порушення функції печінки з/без морфологічних змін при біопсії печінки.
СГСЯ може бути наслідком застосування лХГ та вагітності (ендогенний лХГ). Ранній СГСЯ настає протягом 10 днів після введення лХГ і може бути пов’язаний з підвищеною реакцією яєчників на стимуляцію гонадотропіном. Пізній СГСЯ настає більше ніж через 10 днів після введення лХГ як наслідок гормональних змін при вагітності. Через ризик розвитку СГСЯ необхідно вести моніторинг пацієнток протягом щонайменше 2 тижнів після введення лХГ.
У жінок з відомими факторами ризику інтенсивної відповіді яєчників може бути особлива схильність до розвитку СГСЯ під час або після лікування препаратом Елонва. Стан жінок, що отримують перший цикл стимуляції яєчників, у яких фактори ризику відомі тільки частково, рекомендовано ретельно спостерігати відносно ранніх ознак та симптомів СГСЯ.
Щоб знизити ризик розвитку СГСЯ, до лікування та регулярно під час лікування необхідно проводити ультразвуковий моніторинг розвитку фолікулів. Може бути доцільним одночасне визначення сироваткових рівнів естрадіолу. При ДРТ існує ризик розвитку СГСЯ при наявності 18 або більше фолікулів діаметром 11 мм або більше. При наявності 30 або більше фолікулів введення лХГ рекомендується припинити.
Залежно від реакції яєчників для запобігання СГСЯ можна вжити такі заходи:
- припинити подальшу стимуляцію гонадотропіном протягом максимум 3 діб (відстрочка стимуляції овуляції);
- відкласти застосування лХГ і скасувати цикл лікування;
- застосовувати сечовий лХГ в дозі менше 10000 МО для ініціації остаточного дозрівання овоцита, наприклад 5000 МО сечового лХГ або 250 мкг рекомбінантного лХГ (еквівалентно приблизно 6500 МО сечового лХГ);
- скасувати переніс свіжого ембріону та провести кріоконсервацію ембріонів;
- не застосовувати лХГ для підтримки лютеїнової фази.
Для мінімізації ризику СГСЯ важливо дотримуватися рекомендованої дози препарату Елонва та режиму лікування і вести ретельний моніторинг реакції яєчників. Якщо виникає СГСЯ необхідно провести стандартне та відповідне лікування.
Перекрут яєчника
Повідомлялось про перекрут яєчника після лікування гонадотропінами, включаючи препарат Елонва. Перекрут яєчника може бути пов'язаний з іншими станами, такими як СГСЯ, вагітність, раніше проведеними хірургічними втручаннями в черевній порожнині, перекрут яєчника в анамнезі, а також кісти яєчника в анамнезі або в теперішній час. Ушкодження яєчника внаслідок ослаблення кровотоку може бути попереджено, якщо діагноз встановлений своєчасно та негайно усунений перекрут.
Багатоплідна вагітність та пологи
При застосуванні всіх гонадотропінів, включаючи препарат Елонва, спостерігались випадки багатоплідної вагітності та народження декількох дітей. Перед початком лікування жінку та її партнера необхідно проінформувати про потенційний ризик для матері (ускладнення вагітності та пологів) та для новонароджених (низька маса тіла при народженні). У жінок, які проходять процедуру ДРТ, ризик багатоплідної вагітності пов’язаний, головним чином, з кількістю пересаджених ембріонів.
Позаматкова вагітність
У безплідних жінок, яким запропоновано лікування методами ДРТ, підвищена частота позаматкової вагітності. Дуже важливо провести ультразвукове дослідження на ранніх стадіях вагітності, щоб підтвердити маткову та виключити позаматкову вагітність.
Вроджені пороки
Частота вроджених пороків розвитку після застосування ДРТ може бути дещо вищою, ніж після спонтанного зачаття. Вважається, що це зумовлено відмінностями в характеристиках батьків (наприклад, вік матері, характеристики сперми) та підвищеною частотою багатоплідних вагітностей.
Пухлина яєчників та інших репродуктивних органів
Існують повідомлення про доброякісні та злоякісні новоутворення яєчників та інших органів репродуктивної системи у жінок, які при лікуванні безпліддя перенесли численні курси медикаментозного лікування. Не встановлено, чи може лікування гонадотропінами привести до підвищення ризику розвитку таких пухлин у безплідних жінок.
Судинні ускладнення
Повідомлялось про тромбоемболічні розлади (пов’язані або непов’язані з СГСЯ) після лікування гонадотропінами, включаючи препарат Елонва.
Внутрішньосудинний тромбоз, як венозних так і артеріальних судин, може приводить до ослаблення притоку крові до життєво важливих органів та кінцівок. У жінок із загальновизнаними факторами ризику виникнення тромбоемболічних розладів, таких як особистий чи сімейний анамнез, тяжка форма ожиріння або тромбофілія, застосування гонадотропінів, включаючи препарат Елонва, може призвести до подальшого зростання такого ризику. Для таких жінок необхідно порівняти позитивний ефект від прийому гонадотропінів з ризиками. Необхідно зауважити, що вагітність сама по собі також веде до підвищеного ризику розвитку тромбозів.
Застосування у період вагітності або годування груддю.
Вагітність.
Застосування препарату Елонва під час вагітності протипоказане.
Недостатньо клінічних даних, щоб виключити небажаний наслідок вагітності у випадку неумисного застосування препарату.
При дослідженні на тваринах була відмічена репродуктивна токсичність.
Годування груддю.
Застосування препарату Елонва під час годування груддю не показано.
Фертильність.
Препарат Елонва показаний для лікування безпліддя (див. розділ «Показання»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження впливу на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами не проводилися.
Оскільки препарат може викликати запаморочення, пацієнткам рекомендується уникати керування автотранспортом або роботи з іншими механізмами протягом застосування препарату.
Спосіб застосування та дози.
Лікування препаратом Елонва необхідно починати під наглядом лікаря, який має досвід лікування безпліддя.
Дозування
При лікуванні жінок репродуктивного віку доза препарату Елонва залежить від маси тіла та віку жінки.
Рекомендована одноразова доза препарату становить 100 мкг для жінок:
- маса тіла яких менш ніж або дорівнює 60 кг та віком 36 років або молодших.
Рекомендована одноразова доза препарату становить 150 мкг для жінок:
- маса тіла яких більш ніж 60 кг, незалежно від віку,
- маса тіла яких 50 кг або більше та віком понад 36 років.
Жінки віком понад 36 років, які важать менш ніж 50 кг, не досліджувались.
| | Маса тіла |
| Менш ніж 50 кг | 50-60 кг | Більш ніж 60 кг |
| Вік | 36 років або молодші | 100 мкг | 100 мкг | 150 мкг |
| Понад 36 років | Не досліджувались | 150 мкг | 150 мкг |
Рекомендовані дози препарату Елонва були встановлені лише в режимі лікування з антагоністом ГРГ, що вводився, починаючи з 5-го або 6-го дня стимуляції (також див. розділи «Показання» та «Особливості застосування»).
1-й день стимуляції:
Препарат Елонва необхідно застосовувати у вигляді одноразової підшкірної ін’єкції, бажано в черевну стінку на початку фолікулярної фази менструального циклу.
5-й або 6-й день стимуляції:
Лікування антагоністом ГРГ необхідно починати на 5-й або 6-й день стимуляції залежно від реакції яєчників, тобто від кількості і розміру зростаючих фолікулів і кількості естрадіолу в крові. Також може знадобиться одночасне визначення рівнів естрадіолу в сироватці крові. Антагоніст ГРГ застосовують для запобігання передчасних викидів лютеїнізуючого гормону (ЛГ).
8-й день стимуляції:
Через 7 днів після ін’єкції препарату Елонва на перший день стимуляції, можна продовжити КСЯ лікування з щоденними ін’єкціями (рекомбінантного) фолікулостимулюючого гормону (рФСГ) до досягнення критеріїв ініціації остаточного дозрівання ооцитів (3 фолікули ≥17 мм). Щоденна доза рФСГ може залежати від реакції яєчників. Для пацієнтів з нормальною реакцією на лікування рекомендована щоденна доза становить 150 МО рФСГ. Введення рФСГ у день введення лХГ можна пропустити, залежно від реакції яєчників. Як правило, адекватний розвиток фолікулів досягається у середньому до дев'ятої доби лікування (з діапазоном від 6 до 18 доби).
Як тільки буде спостерігатися 3 фолікули ≥17 мм, у той же день або наступного дня для індукції остаточного дозрівання ооцитів вводиться від 5 000 до 10 000 МО лХГ. У разі підвищеної реакції яєчників для мінімізації ризику розвитку СГСЯ: див. рекомендації, наведені в розділі «Особливості застосування».
Окремі групи пацієнтів
Порушення функції нирок
Клінічні дослідження у пацієнтів з порушеннями функції нирок не проводились. Оскільки введення корифолітропіну альфа може бути знижено у пацієнтів з порушенням функції нирок, використання препарату Елонва в таких випадках не рекомендується.
Порушення функції печінки
Дані про пацієнток з погіршеною функцією печінки відсутні, однак малоймовірно, що печінкова недостатність впливає на виведення корифолітропіну альфа.
Спосіб введення
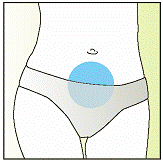
Елонву необхідно вводити шляхом ін’єкції під шкіру (підшкірно) в складку шкіри (затиснуту між великим та вказівним пальцями), безпосередньо нижче пупка. Ін’єкцію може робити медичний працівник (наприклад медсестра), сама жінка або її партнер, які належним чином проінструктовані лікарем. При застосуванні препарату Елонва точно дотримуйтеся вказівок лікаря. Якщо Ви в чомусь не впевнені, ще раз проконсультуйтесь з лікарем. Пошагова інструкція по застосуванню препарату Елонва наведена нижче.
Не вводьте препарат Елонва в м’язи.
Інструкція з введення препарату
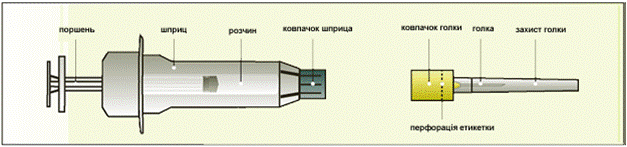
Приготування ін’єкції
| 
| 1 - Перед застосуванням препарату Елонва помийте руки водою з милом та висушить їх.
- Протріть місце ін’єкції (ділянку нижче пупка) в місці введення голки дезинфекційним засобом (наприклад, спиртом), щоб видалити з поверхні будь-які бактерії.
- Протріть близько 5 см шкіри навколо точки, де буде введена голка. Нехай дезінфікуючий засіб висохне протягом не менше 1 хвилини, перш ніж продовжити.
|
| 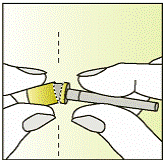
| 2 - Після висихання дезинфікуючого засобу зламайте перфорацію етикетки і зніміть ковпачок голки.
- Залиште захист голки на голці.
- Покладіть голку із захистом (містить голку) на чисту суху поверхню при приготуванні шприца до ін’єкції.
|
| 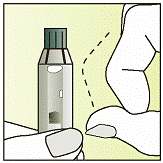
| 3 - Тримайте шприц сірим ковпачком догори.
- Легенько постукайте по шприцу пальцем, щоб бульбашки повітря піднялися в його верхню частину.
|
| 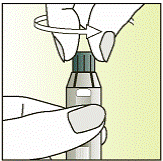
| 4 - Тримайте шприц міткою догори.
- Згвинтіть ковпачок шприца проти годинникової стрілки.
|
| 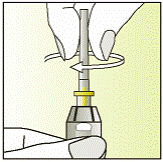
| 5 - Тримайте шприц міткою догори.
- Нагвинтіть голку із захистом (містить голку) за годинниковою стрілкою на шприц.
|
| 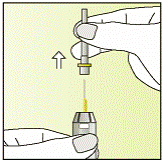
| 6 - Тримайте шприц міткою догори.
- Зніміть захист голки вертикально вгору.
- БУДЬТЕ ОБЕРЕЖНІ з голкою.
|
Виконання ін’єкції
| 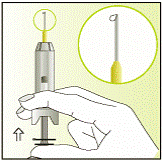
| 7 - Тепер помістіть шприц між вказівним та середнім пальцем, поверніть шприц догори.
- Покладіть великий палець на поршень.
- Обережно натискайте на поршень вгору, поки на кінчику голки не з’явиться крапелька.
|
| 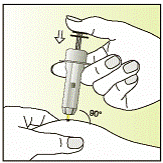
| 8 - Великим та вказівним пальцями затисніть складку шкіри.
- Введіть у складку шкіри всю голку під кутом 90 градусів.
- Обережно натискайте на поршень до тих пір, поки він може рухатися вперед, і утримуйте його в цьому положенні.
- ПОРАХУЙТЕ ДО П’ЯТИ, щоб пересвідчитися, що введено увесь розчин.
|
| 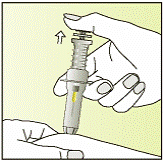
| 9 - Зніміть великий палець з поршня.
- Голку буде автоматично втягнуто в шприц, де вона буде постійно заблокована.
|
Діти.Препарат не застосовують для стимуляції яєчників у пацієнтів дитячого віку.
Передозування.
Ймовірно, що введення більш ніж 1 ін’єкції препарату Елонва протягом одного циклу лікування або застосування завищених доз препарату та/чи рФСГ підвищать ризик розвитку СГСЯ.
Засоби щодо запобігання зниження ризику та лікування СГСЯ дивися в розділі «Особливості застосування».
Побічні реакції.
Короткий профіль безпеки
Під час лікування препаратом Елонва найчастіше повідомлялося про такі побічні реакції, що спостерігалися в клінічних дослідженнях (N=2 397), як: дискомфорт у тазовій ділянці (6,0%), СГСЯ (4,3%, також див. розділ «Особливості застосування»), головний біль (4,0%), біль у тазовій ділянці (2,9%), нудота (2,3%), втома (1,5%) та болючість молочних залоз (1,3%).
Перелік побічних реакцій
У таблиці нижче наведено основні побічні реакції, що спостерігалися у жінок при застосуванні препарату Елонва під час клінічних досліджень та постмаркетингових спостережень, які розподілені за системами організму та частотою їх виникнення: дуже часто (> 1/10), часто (від > 1/100 до < 1/10), нечасто (від > 1/1000 до < 1/100), рідко (від > 1/10000 до < 1/1000), дуже рідко (< 1/10000) та невідомо (не може бути оцінена за відомими даними). У межах кожної частотної групи побічні реакції представлені в порядку зменшення серйозності.
| Системно-органний клас | Частота виникнення | Побічні реакції |
| Порушення з боку імунної системи | Невідомо | Реакції гіперчутливості, як локальні, так і генералізовані, включаючи висип* |
| Психіатричні розлади | Нечасто | Перепади настрою |
| Порушення з боку нервової системи | Часто | Головний біль |
| Нечасто | Запаморочення |
| Порушення з боку судин | Нечасто | Прилив крові |
| Порушення з боку шлунково-кишкового тракту | Часто | Нудота |
| Нечасто | Біль у животі, блювання, діарея, запор |
| Порушення з боку опорно-рухового апарату та сполучних тканин | Нечасто | Біль у ділянці спини |
| Вагітність, період після пологів та перинатальний період | Нечасто | Самовільний аборт |
| Порушення з боку репродуктивної системи та молочних залоз | Часто | СГСЯ, біль і дискомфорт у тазовій ділянці, болючість молочних залоз |
| Нечасто | Перекрут яєчників, біль у ділянці придатків матки, передчасна овуляція, біль у молочних залозах |
| Загальні розлади та стани в місці введення | Часто | Втома |
| Нечасто | Крововилив у місці введення, біль у місці введення, подразнення |
| Аналізи | Нечасто | Підвищений рівень аланін амінотрансферази, підвищений рівень аспартат амінотрансферази |
| Травми, отруєння та процедурні ускладнення | Нечасто | Біль під час проведення процедури |
* Побічні реакції були ідентифіковані за допомогою постмаркетингового спостереження.
Опис деяких побічних реакцій
Крім того, повідомлялося про позаматкову вагітність та багатоплідну вагітність. Вважається, що вони пов’язані з процедурою ДРТ або подальшою вагітністю.
В поодиноких випадках тромбоемболія асоціювалася з терапією препаратом Елонва, як і при інших гонадотропінах.
Термін придатності. 3 роки.
Умови зберігання.
Зберігати в захищеному від світла, недоступному для дітей місці при температурі 2-8 ˚С.
Несумісність.
Відсутні дані щодо сумісності з іншими лікарськими засобами. Розчин для ін’єкцій не можна змішувати з іншими лікарськими засобами.
Упаковка.
По 0,5 мл розчину в попередньо наповненому шприці із гідролітичного скла типу 1 з фіксатором голки, гумовим поршнем та наконечником. Шприц обладнаний автоматичною системою безпеки (для попередження пошкоджень голкою після використання). По 1 попередньо наповненому шприцу разом зі стерильною ін’єкційною голкою у відкритому пластиковому лотку та інструкцією для медичного застосування в картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Н.В. Органон, Нідерланди.
Органон (Ірландія) Лтд, Ірландія.
Місцезнаходження виробника та адреса місця провадження його діяльності.
5349 АВ Осс, Клоостерштраат 6, Нідерланди (юридична адреса).
Моленштраат 110, 5342 СС Осс, Нідерланди (адреса місця провадження діяльності).
Драйнем Роад Свордс, Ко. Дублін, Ірландія.
